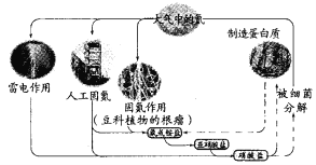
ƒøƒ⁄»ð
°æƒø°øƒø«∞£¨Ã˙ « π”√◊Óπ„∑∫µƒΩ Ù÷Æ“ª£¨“—÷™‘⁄∏þŒ¬œ¬£¨Fe”ÎÀÆ’Ù∆¯ø…∑¢…˙∑¥”¶£Æ”¶”√»ÁÕº◊∞÷√£¨‘⁄”≤÷ ≤£¡ßπÐ÷–∑≈»Îªπ‘≠Ã˙∑€∫Õ Ø√Þ»ÞµƒªÏ∫œŒÔ£¨º”»»£¨≤¢Õ®»ÎÀÆ’Ù∆¯£¨æÕø…“‘ÕÍ≥…∏þŒ¬œ¬°∞Fe”ÎÀÆ’Ù∆¯µƒ∑¥”¶ µ—È°±£Æ 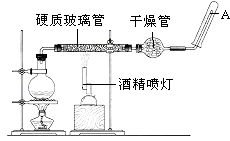
«Îªÿ¥œ¬¡–µƒŒ £Æ
£®1£©Ã˙‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√ « £Æ
£®2£©«Î–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫ £Æ
£®3£©‘¯¿˚”√¬¡∫ÕÃ˙µƒ—ıªØŒÔ∑¥”¶‘≠¿Ì¿¥∫∏Ω”∏÷πÏ£¨∏√∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™ £Æ
£®4£©œ÷”–Ã˙∫Õ≤¨◊È≥…µƒ∫œΩπ≤a mol£¨∆‰÷–PtµƒŒÔ÷ µƒ¡ø∑÷ ˝Œ™x£¨—–≥…∑€ƒ©◊¥∫Û»´≤øÕ∂»Î∫¨b mol HNO3µƒœ°»Ð“∫÷–£¨ π∆‰≥‰∑÷∑¥”¶£¨«“HNO3µƒªπ‘≠≤˙ŒÔ÷ª”–NO£Æ ‘ªÿ¥œ¬¡–Œ £∫ ¢ŸÀÊHNO3”√¡øµƒ‘ˆº”£¨»Ð“∫÷–µƒΩ Ù¿Î◊”∫Õ≤–¡ÙπÃõƒ≥…∑÷“¿¥Œ”–Àƒ÷÷«Èøˆ£¨«Î”√¡£◊”∑˚∫≈ÃÓ–¥œ¬±Ìø’∞◊£∫
¢Ÿ | ¢⁄ | ¢€ | ¢Ð | |
»Ð“∫÷–µƒΩ Ù¿Î◊” | Fe2+ | |||
≤–¡ÙπÃÃÂ≥…∑÷ | Fe°¢Pt | Pt | Pt |
¢⁄µ±x=0.5£¨«“»Ð“∫÷–Fe3+”ÎFe2+∫ÕŒÔ÷ µƒ¡øœýµ»£¨‘⁄±Í◊º◊¥øˆœ¬π≤≤˙…˙112mL NO£Æ‘Úa= £¨ b= £Æ
°æ¥∞∏°ø
£®1£©µ⁄Àƒ÷Ð∆⁄,µ⁄¢¯◊Â
£®2£©3Fe+4H2O£®g£© ![]() Fe3O4+4H2°¸
Fe3O4+4H2°¸
£®3£©2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
£®4£©Fe2+£ª Fe2+Fe3+£ª Fe3+£ª Fe2+£ª0.012£ª0.02
°æΩ‚Œˆ°øΩ‚£∫£®1£©Feµƒ‘≠◊”–Ú ˝Œ™26£¨‘≠◊”Ω·ππ÷–”–4∏ˆµÁ◊”≤„£¨◊ÓÕ‚≤„µÁ◊” ˝Œ™2£¨‘ÚŒª”⁄‘™Àÿ÷Ð∆⁄±Ì÷–µ⁄Àƒ÷Ð∆⁄£¨µ⁄¢¯◊£¨À˘“‘¥∞∏ «£∫µ⁄Àƒ÷Ð∆⁄£¨µ⁄¢¯◊£ª£®2£©Fe”ÎÀÆ’Ù∆¯∑¥”¶…˙≥…Àƒ—ıªØ»˝Ã˙∫Õ«‚∆¯£¨∑¥”¶Œ™3Fe+4H2O£®g£© ![]() Fe3O4+4H2°¸£¨À˘“‘¥∞∏ «£∫3Fe+4H2O£®g£©
Fe3O4+4H2°¸£¨À˘“‘¥∞∏ «£∫3Fe+4H2O£®g£© ![]() Fe3O4+4H2°¸£ª£®3£©¬¡∫ÕÃ˙µƒ—ıªØŒÔ∑¥”¶…˙≥…—ıªØ¬¡∫ÕFe£¨∑¥”¶Œ™2Al+Fe2O3
Fe3O4+4H2°¸£ª£®3£©¬¡∫ÕÃ˙µƒ—ıªØŒÔ∑¥”¶…˙≥…—ıªØ¬¡∫ÕFe£¨∑¥”¶Œ™2Al+Fe2O3 ![]() Al2O3+2Fe£¨À˘“‘¥∞∏ «£∫2Al+Fe2O3
Al2O3+2Fe£¨À˘“‘¥∞∏ «£∫2Al+Fe2O3 ![]() Al2O3+2Fe£ª£®4£©¢ŸÀÊHNO3”√¡øµƒ‘ˆº”£¨œıÀ·≤ª◊„£¨∑¢…˙3Fe+8HNO3=3Fe£®NO3£©2+2NO°¸+4H2O£¨Ω Ù¿Î◊”Œ™Fe2+£¨≤–¡ÙπÃÃÂ≥…∑÷Œ™Fe°¢Pt£ª
Al2O3+2Fe£ª£®4£©¢ŸÀÊHNO3”√¡øµƒ‘ˆº”£¨œıÀ·≤ª◊„£¨∑¢…˙3Fe+8HNO3=3Fe£®NO3£©2+2NO°¸+4H2O£¨Ω Ù¿Î◊”Œ™Fe2+£¨≤–¡ÙπÃÃÂ≥…∑÷Œ™Fe°¢Pt£ª
»ÙœıÀ·”ÎFe«°∫√∑¢…˙3Fe+8HNO3=3Fe£®NO3£©2+2NO°¸+4H2O£¨Ω Ù¿Î◊”Œ™Fe2+£¨≤–¡ÙπÃÃÂ≥…∑÷Œ™Pt£ª
‘⁄…œ ˆ∑¥”¶ª˘¥°…œ£¨‘Ÿº”œıÀ·£¨∑¢…˙3Fe2++4H++NO3©Å=3Fe3++NO°¸+2H2O£¨‘ÚΩ Ù¿Î◊”Œ™Fe2+ Fe3+£¨≤–¡ÙπÃÃÂ≥…∑÷Œ™Pt£ª
»Ù—«Ã˙¿Î◊”«°∫√±ª—ıªØ£¨‘Ú∑¢…˙3Fe2++4H++NO3©Å=3Fe3++NO°¸+2H2O£¨‘ÚΩ Ù¿Î◊”Œ™Fe3+£¨≤–¡ÙπÃÃÂ≥…∑÷Œ™Pt£ª
À˘“‘¥∞∏ «£∫
¢Ÿ | ¢⁄ | ¢€ | ¢Ð | |
»Ð“∫÷–µƒΩ Ù¿Î◊” | Fe2+ | Fe2+ | Fe2+ Fe3+ | Fe3+ |
≤–¡ÙπÃÃÂ≥…∑÷ | Fe°¢Pt | Pt | Pt | Pt |
¢⁄x=0.5£¨«“»Ð“∫÷–Fe3+”ÎFe2+∫ÕŒÔ÷ µƒ¡øœýµ»£¨‘ÚŒÔ÷ µƒ¡øæ˘Œ™0.25amol£¨”…µÁ◊” ÿ∫„ø…÷™£¨0.25a°¡2+0.25a°¡3= ![]() °¡£®5©Å2£©£¨Ω‚µ√a=0.012£¨
°¡£®5©Å2£©£¨Ω‚µ√a=0.012£¨
”…N‘≠◊” ÿ∫„ø…÷™b=0.25°¡0.012mol°¡2+0.25°¡0.012mol°¡3+ ![]() =0.02£¨
=0.02£¨
À˘“‘¥∞∏ «£∫0.012£ª0.02£Æ

 ΩÚ«≈ΩÔ˝ ÓºŸ∞Œ∏þœŒΩ”π„∂´»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏
ΩÚ«≈ΩÔ˝ ÓºŸ∞Œ∏þœŒΩ”π„∂´»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏ ≤®≤®–Ð ÓºŸ◊˜“µΩ≠Œ˜»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏
≤®≤®–Ð ÓºŸ◊˜“µΩ≠Œ˜»À√Ò≥ˆ∞Ê…Áœµ¡–¥∞∏ —ß∂¯”≈ Ó∆⁄œŒΩ”ƒœæ©¥Û—ß≥ˆ∞Ê…Áœµ¡–¥∞∏
—ß∂¯”≈ Ó∆⁄œŒΩ”ƒœæ©¥Û—ß≥ˆ∞Ê…Áœµ¡–¥∞∏°æƒø°øƒ≥øŒÕ‚–°◊ȅ˺∆µƒ µ—È “÷∆»°““À·““ı•µƒ◊∞÷√»ÁÕºÀ˘ 棨A÷– ¢”–≈®H2SO4 £¨ B÷– ¢”–““¥º°¢ŒÞÀÆ¥◊À·ƒ∆£¨D÷– ¢”–±•∫ÕúÀ·ƒ∆»Ð“∫£Æ 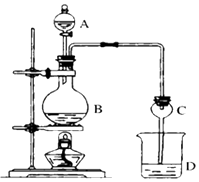
“—÷™£∫¢ŸŒÞÀƬ»ªØ∏∆ø…”Γ“¥º–Œ≥…ƒ—»Ð”⁄ÀƵƒCaCl26C2H5OH£Æ
¢⁄”–πÿ”–ª˙ŒÔµƒ∑–µ„£∫
‘º¡ | ““√— | ““¥º | ““À· | ““À·““ı• |
∑–µ„£®°Ê£© | 34.7 | 78.5 | 118 | 77.1 |
«Îªÿ¥£∫
£®1£©≈®¡ÚÀ·µƒ◊˜”√£ª»Ù”√Õ¨ŒªÀÿ18O æ◊Ÿ∑®»∑∂®∑¥”¶≤˙ŒÔÀÆ∑÷◊”÷–—ı‘≠◊”µƒÃ·π©’þ£®…Ë18O°Ê‘⁄CH3CH2OH÷–£©£¨–¥≥ˆƒÐ±Ì æ18OŒª÷√µƒªØ—ß∑Ω≥Ã Ω £Æ
£®2£©«Ú–Œ∏…‘ÔπÐCµƒ◊˜”√ « £Æ »Ù∑¥”¶«∞œÚD÷–º”»Îº∏µŒ∑”Ù£¨»Ð“∫≥ ∫Ï…´£¨≤˙…˙¥Àœ÷œÛµƒ‘≠“Ú «£®”√¿Î◊”∑Ω≥Ã Ω±Ì æ£©£∫£ª∑¥”¶Ω· ¯∫ÛD÷–µƒœ÷œÛ « £Æ
£®3£©¥”D÷–∑÷¿Î≥ˆµƒ““À·““ı•÷–≥£∫¨”–“ª∂®¡øµƒ““¥º°¢““√—∫ÕÀÆ£¨”¶œ»º”»ÎŒÞÀƬ»ªØ∏∆£¨∑÷¿Î≥ˆ£ª‘Ÿº”»ÎŒÞÀÆ¡ÚÀ·ƒ∆£¨»ª∫ÛΩ¯––’Ù¡Û£¨ ’ºØ≤˙∆∑““À·““ı• ±£¨Œ¬∂»”¶øÿ÷∆‘⁄◊Û”“£Æ