��Ŀ����
����Ŀ��ij�¶�ʱ��±������AgX��X=Cl��Br��I����3���ܽ� ƽ��������ͼ��ʾ��AgCl��AgBr��AgI��Ksp���μ�С����֪pAg=��lgc��Ag+����pX=��lgc��X����������pX��pAg������ϵ�ɱ�ʾ�� AgX���ܶȻ�����Һ�е�c��Ag+����c��X���������ϵ������˵��������ǣ� �� 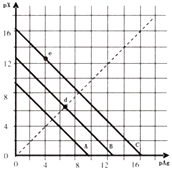
A.A����AgCl��C����Ag I
B.e���ʾ�ɹ�����KI��AgNO3��Ӧ����AgI����
C.d������ˮ�м���������AgBr�γɵı�����Һ
D.B��һ����AgBr
���𰸡�B
���������⣺A����֪pAg=��lgc��Ag+����pX=��lgc��X�����������ӡ�������Ũ��Խ��Ũ�ȵĸ������õ���ֵԽС������ͼ�������֪���Ȼ����ܽ�ȴ����廯�����ڵ⻯������Һ�е�����Ũ��Ҳ���Ȼ����ܽ�ȴ����廯�����ڵ⻯��������A�߱�ʾ����AgCl��B�߱�ʾ����AgBr��C�߱�ʾ����AgI����A��ȷ�� B����Ϊe���������ϣ������ڳ������ܽ�ƽ��״̬�������ھ����ɳ������в��ֳ����ܽ�����⣬��ʾ���ǵ⻯���������ܽ����ƽ��״̬����B����
C��d���dz����ܽ�ƽ�����ϵ�һ�㣬˵���dz����ܽ�ƽ��״̬�µı�����Һ����C��ȷ��
D�������Ȼ����ܽ�ȴ����廯���ܽ�ȴ��ڵ⻯���ܽ�ȣ���֪������Һ������Ũ��AgCl��AgBr��AgI�����pAg=��lgc��Ag+����pX=��lgc��X������ͼ�����ݷ����õ���B��һ�����廯���ij����ܽ�ƽ���ߣ���D��ȷ��
��ѡB��
A����֪pAg=��lgc��Ag+����pX=��lgc��X�����������ӡ�������Ũ��Խ��Ũ�ȵĸ������õ���ֵԽС������ͼ�������֪���Ȼ����ܽ�ȴ����廯�����ڵ⻯������Һ�е�����Ũ��Ҳ���Ȼ����ܽ�ȴ����廯�����ڵ⻯��������A�߱�ʾ����AgCl��B�߱�ʾ����AgBr��C�߱�ʾ����AgI��
B����Ϊe���������ϣ������ڳ������ܽ�ƽ��״̬�������ھ����ɳ������в��ֳ����ܽ�����⣬��ʾ���ǵ⻯���������ܽ����ƽ�⣻
C��d���dz����ܽ�ƽ�����ϵ�һ�㣬˵���dz����ܽ�ƽ��״̬�µı�����Һ��
D�������Ȼ����ܽ�ȴ����廯���ܽ�ȴ��ڵ⻯���ܽ�ȣ���֪������Һ������Ũ��AgCl��AgBr��AgI�����pAg=��lgc��Ag+����pX=��lgc��X������ͼ�����ݷ����õ���

 ��ĩ1�����ʽ���������ϵ�д�
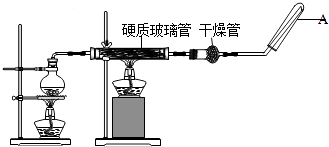
��ĩ1�����ʽ���������ϵ�д�����Ŀ��ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A��ʢ��ŨH2SO4 �� B��ʢ���Ҵ�����ˮ�����ƣ�D��ʢ�б���̼������Һ�� 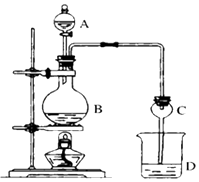
��֪������ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl26C2H5OH��
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
��ش�
��1��Ũ���������������ͬλ��18Oʾ�ٷ�ȷ����Ӧ����ˮ��������ԭ�ӵ��ṩ�ߣ���18O����CH3CH2OH�У���д���ܱ�ʾ18Oλ�õĻ�ѧ����ʽ ��
��2�����θ����C�������� �� ����Ӧǰ��D�м��뼸�η�̪����Һ�ʺ�ɫ�������������ԭ���ǣ������ӷ���ʽ��ʾ��������Ӧ������D�е������� ��
��3����D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ���������ټ�����ˮ�����ƣ�Ȼ����������ռ���Ʒ��������ʱ���¶�Ӧ���������ң�