题目内容
2.对于反应COCl2(g)?CO(g)+Cl2(g)△H=-QkJ•mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是( )
| A. | 一定条件下,该反应在任何温度下均能自发进行 | |
| B. | 反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为K | |
| C. | 反应2COCl2(g)?2CO(g)+2Cl2(g) 化学平衡常数为2K | |
| D. | 将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
分析 A、化学反应能否自发进行,取决于焓变和熵变的综合判据;
B、互为逆过程的两个反应,平衡常数之积为1;
C、化学平衡常数表达式与方程式的书写有关,系数扩大2倍,平衡常数是原平衡常数的平方;
D、可逆反不可能完全转化.
解答 解:A、已知:COCl2(g)?CO(g)+Cl2(g)△H=-QkJ•mol-1(Q>0),由方程式中气体的计量数可知反应后气体物质的量增大,所以熵增加,即△S>0,而△H<0,所以该反应在任何温度下均能自发进行,故A正确;
B、反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为$\frac{1}{K}$,故B错误;
C、反应2COCl2(g)?2CO(g)+2Cl2(g),的系数是COCl2(g)?CO(g)+Cl2(g)的2倍,所以化学平衡常数为K2,故C错误;
D、可逆反不可能完全转化,所以将1mol COCl2 (g)置于一密闭容器中充分反应后放出热量小于QkJ,故D错误;
故选A.
点评 本题考查反应热与焓变,反应方向的判断和化学平衡常数的相关知识,题目难度不大,注意自由能判据的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.有A、B两种短周期主族元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
| A. | 若B(OH)m 是强碱,则A(OH)m一定为强碱 | |
| B. | 若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 | |
| C. | 若B是金属,则A可能是非金属,若B是非金属,则A不可能是金属 | |
| D. | 若HnAOm是强酸,则A元素的氢化物的水溶液一定显酸性 |
10.下列解释物质用途或现象的反应方程式不准确的是( )
| A. | 硫酸型酸雨的形成会涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | 工业上制取粗硅的化学方程式SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl?+ClO?+2H+=Cl2↑+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:S2O32-+2H+=SO2↑+S↓+H2O |
17.下列离子组在给定条件下,离子共存判断及反应的离子方程式均正确的是( )
| 选项 | 条 件 | 离子组 | 离子共存判断及离子方程式 |
| A | 常温下,由水电离出的C(H+)为1×10-12 mol•L-1 | K+、Cl-、S2-SO32- | 一定能大量共存 |
| B | 滴加氨水 | Na+、Fe3+、Cl- | 不能大量共存 Fe3++3OH-═Fe(OH)3↓ |
| C | p=1的溶液 | Fe3+、I- Cl- | 不能大量共存 2Fe3++2I-═2Fe2++I2 |
| D | 通入少量SO2气体 | K+、Na+、ClO- | 不能大量共存 2ClO-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
7.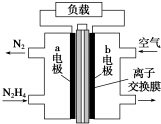 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )
 液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )
液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液.下列关于该电池的叙述错误的是( )| A. | b极发生还原反应 | |
| B. | a极的反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 放电时,电流从b极经过负载流向a极 | |
| D. | 其中的离子交换膜需选用阴离子交换膜 |
14.某烃的分子量为84,可使酸性高锰酸钾溶液褪色,该烃的链状且主链上有4个碳原子的同分异构体的数目是( )(不考虑顺反异构)
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 O
O