题目内容
12.写出下列反应的离子方程式.①足量稀硝酸与CaCO3反应的离子方程式:2H++CaCO3=Ca2++CO2↑+H2O
②稀硫酸和氢氧化钡溶液反应的离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
③等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式:Ba2++HCO3-+OH-═BaCO3↓+H2O.
分析 ①反应生成硝酸钙、水、二氧化碳,碳酸钙、水、二氧化碳在离子反应中保留化学式;
②反应生成硫酸钡和水;
③等物质的量反应,生成碳酸钡、水、NaOH.
解答 解:①足量稀硝酸与CaCO3反应的离子方程式为2H++CaCO3=Ca2++CO2↑+H2O,故答案为:2H++CaCO3=Ca2++CO2↑+H2O;
②稀硫酸和氢氧化钡溶液反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
③等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式为Ba2++HCO3-+OH-═BaCO3↓+H2O,故答案为:Ba2++HCO3-+OH-═BaCO3↓+H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、与量有关的离子反应考查,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
2.对于反应COCl2(g)?CO(g)+Cl2(g)△H=-QkJ•mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是
( )
( )
| A. | 一定条件下,该反应在任何温度下均能自发进行 | |
| B. | 反应CO(g)+Cl2(g)?COCl2(g)△H=+Q kJ•mol-1 化学平衡常数为K | |
| C. | 反应2COCl2(g)?2CO(g)+2Cl2(g) 化学平衡常数为2K | |
| D. | 将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
17.下列物质中,属于盐类的是( )
| A. | MgO | B. | NaOH | C. | H2SO4 | D. | BaCO3 |
4.可以证明烧杯中的硝酸钾溶液是饱和溶液的方法是( )
| A. | 蒸发掉1克水,有少量固体析出 | B. | 降低温度,有少量固体析出 | ||
| C. | 加入少量硝酸钾固体,固体不溶解 | D. | 加入少量水,没有固体析出 |
1.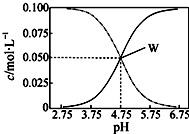 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.1 mol/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
2.区分下列各组物质的方法不正确的是( )
| A. | 水和双氧水--加二氧化锰 | |
| B. | 二氧化碳和氮气--将燃着的木条伸入瓶中 | |
| C. | 高锰酸钾和二氧化锰--看颜色 | |
| D. | 石灰水和水--通二氧化碳 |
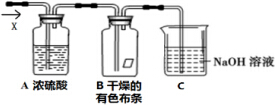 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: