题目内容
1.在标准状况下,将4.48LSO2、CO2、H2的混合气通入适量的饱和NaHCO3溶液中,充分反应后,若溶液中的溶质只有NaHSO3,并且逸出的4.6g气体中只有CO2和H2,则原有混合气体中SO2、CO2、H2的体积比可能是( )| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
分析 根据反应SO2+NaHCO3═NaHSO3+CO2可知逸出气体的体积没变,求出混合气体的平均摩尔质量,进而求出CO2和H2的体积比,最后得出SO2与CO2体积之和与氢气的体积的关系,判断选项的正误.
解答 解:标准状况下,4.48L气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
由于“逸出的气体只有CO2和H2”根据SO2+NaHCO3═NaHSO3+CO2可知,逸出的气体体积没变,则二氧化碳和氢气组成的混合气体的平均摩尔质量为:$\frac{4.6g}{0.2mol}$=23g/mol,
设混合气体中CO2的物质的量为x,H2的物质的量为y,则$\frac{44x+2y}{x+y}$=23,整理可得x:y=1:1,
即逸出气体中CO2和H2的体积比为1:1,
则原混合气体中SO2与CO2体积之和等于氢气的体积,选项中BC都符合,
故选BC.
点评 本题考查混合反应的计算,题目难度不大,根据反应前后气体的变化特点得出SO2与CO2体积之和与氢气的体积的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.硫酸具有重要的用途,某工厂用如图2示的工艺流程生产硫酸.
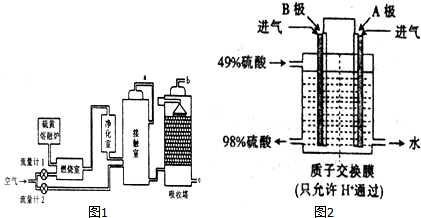
请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
该铵盐的成分是NH4HSO3和(NH4)2SO3,其物质的量之比是1:1.

请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
16.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(PO4)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于( )
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |
6.为配制c(NH4+):c(Cl-)=1:1的溶液,可在NH4Cl溶液中加入适量( )
| A. | 盐酸 | B. | 硫酸 | C. | 氨水 | D. | NaOH溶液 |
10.四种短周期元素X、Y、Z、W的原子序数依次增大.X与Z位于同一主族,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | Y的阳离子半径比W的阴离子半径小 | |
| B. | 气态氢化物的稳定性:X<Z<W | |
| C. | X、Z、W的氧化物对应的水化物的酸性强弱:X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液的pH<7 |