题目内容
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1 L 1 mol/L K2SO4 溶液中含有氧原子数为0.4NA
B.67.2L氯气所含的原子数是6NA
C.常温常压下,11.2 LO2含有电子数为8NA
D.在标准状况下,2.24LN2和O2的混合气体所含原子数为0.2NA
【答案】D
【解析】
A.0.1 L 1 mol/L K2SO4 溶液中,n=cv=0.1 L×1mol/L =0.1mol,则含有0.1mol SO42-,含有0.4mol氧原子,即0.4NA个氧原子,除此外,溶液中还有水,水中也含有氧原子,故A错误;
B. 67.2L氯气所含的原子数是6NA,没有告诉是否处于标况,无法计算物质的量,故无法计算粒子的数目,故B错误;
C. 常温常压下,不是在标况下,11.2 LO2不是0.5mol,一个氧分子含有16个电子,含有电子数不是8NA,故C错误;
D. 在标准状况下,22.4L任何气体所含的粒子的数目为1mol,即NA个,2.24LN2和O2的混合气体含有的分子数为=![]() =
=![]() =0.1mol,即0.1NA个电子,氮气的氧气都是双原子分子,故原子数为0.2NA,故D正确;
=0.1mol,即0.1NA个电子,氮气的氧气都是双原子分子,故原子数为0.2NA,故D正确;
答案选D。

【题目】现有甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 25℃ | 三氧化二铁 | 10mL 5%H2O2 |
甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
甲、乙两小组得出如图数据:
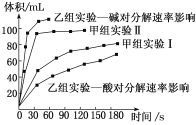
关于该实验下列叙述不正确的是
A. 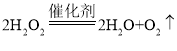 中,O2是氧化产物
中,O2是氧化产物
B. 甲小组实验得出的结论是Fe2O3比MnO2催化效率更高
C. 甲小组实验也可以测定25℃时,在相同时间内产生氧气的体积
D. 乙组研究的影响因素的数据分析,相同条件下H2O2在碱性环境下放出气体速率较快