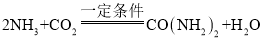题目内容
【题目】研究NOx、CO2的吸收利用,对促进低碳社会的构建和环境的保护具有重要意义。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g)![]() 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______。
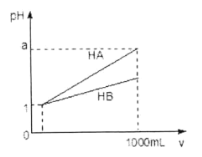
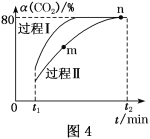
(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)![]() 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。

以下说法正确的是______。
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
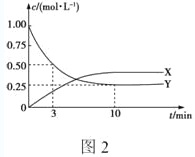
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)______v(逆)(填>、<或=)。判断的理由是______。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。______。

(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为____________。
【答案】(a-3b-2c)kJ/mol AD < 恒温、恒压条件下,再充入3 mol CO2,容器体积变为20L,c(NH3)=0.1mol/L,c(CO2)=0.2mol/L,此时![]() ,平衡逆向移动,所以v(正)<v(逆)
,平衡逆向移动,所以v(正)<v(逆) 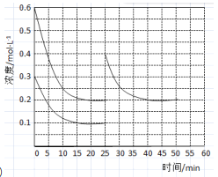
![]()
【解析】
(1)根据盖斯定律,将已知热化学方程式叠加,可得C2H4(g)+6NO(g)![]() 3N2(g)+2CO2(g)+2H2O(l)的反应热△H;
3N2(g)+2CO2(g)+2H2O(l)的反应热△H;
(2)A.催化剂只影响反应速率,不会改变转化率;
B.脱氨率最高的点对应的温度应是最适宜温度,根据图象数据可知,催化剂①、②发挥增大催化效果的温度分别为250℃和450℃;
C.根据反应原理可知,正反应是气体体积增大的反应,压强会影响脱氮率;
D.从脱氮率高低判断反应是否达到平衡;
(3)①若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,此时各物质的浓度减小,根据浓度商规则来进行回答;
②根据等效平衡知识来作图,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变;
(4)放电时铝为负极,被氧化生成Al2Cl7-。
(1)由于反应热与反应途径无关,只与物质的始态和终态有关,所以
①C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
③H2O(l)=H2O(g) △H=c kJ·mol-1
则根据盖斯定律,①-②×3-③×2,整理可得:C2H4(g)+6NO(g)![]() 3N2(g)+2CO2(g)+2H2O(l)
3N2(g)+2CO2(g)+2H2O(l)
△H=(a-3b-2c)kJ/mol;
(2)A.由图象可知,催化剂①、②分别适合于250℃和450℃左右脱氮,其催化活性最好,A正确;
B.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂对转化率没有影响,B错误;
C.该反应的正反应为气体体积增大的反应,所以增大压强,化学平衡向着气体体积减小的逆反应方向移动,所以压强对脱氮率有影响,C错误;
D.在交叉点A处,脱氮率没有达到最大值,所以不管使用哪种催化剂,上述反应都未达平衡状态,D正确;
故合理选项是AD;
(3)①若保持平衡的温度和压强不变,再向容器中充入3mol的氨气,则体系的体积变大,体积为20L,c(NH3)=0.1mol/L,c(CO2)=0.2mol/L,此时![]() ,平衡逆向移动,所以v(正)<v(逆);
,平衡逆向移动,所以v(正)<v(逆);
②25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,则建立的是等效平衡,氨气的平衡浓度保持不变,曲线如下: ,
,
(4)放电时,铝是活泼的金属铝是负极,铝发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-=4Al2Cl7-。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C原子第一至第四电离能如下: I1=738 kJ·mol-1,I2=1451 kJ·mol-1,I3=7733 kJ·mol-1,I4=10540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:________。
(2)B元素基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
![]() ,该同学所画的电子排布图违背了____________。
,该同学所画的电子排布图违背了____________。
(4)G位于第_____族_____区,该元素的核外电子排布式为_____________________________。
(5)检验F元素的方法是____________。