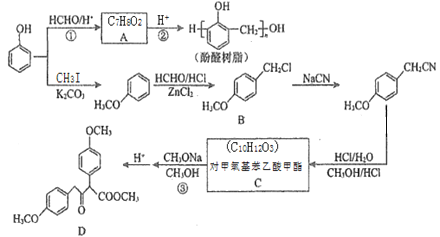
题目内容
【题目】请写出以下溶液的酸碱性(选填“酸性、碱性、中性”)
(1)NaCl溶液______________;
(2)(NH4)2SO4溶液 ___________;
(3)Na2CO3溶液 ___________;
(4)FeCl3溶液 _____________;
(5)CH3COONa溶液 ____________。
【答案】中性 酸性 碱性 酸性 碱性
【解析】
盐是酸碱发生中和反应的产物,根据盐的水解规律:有弱才水解,谁弱谁水解,谁强显谁性分析判断。
(1)NaCl是强酸HCl与强碱NaOH发生中和反应的产物,是强酸强碱盐,不发生水解反应,对水的电离平衡无影响,因此溶液显中性;
(2)(NH4)2SO4是强酸H2SO4与弱碱NH3H2O发生中和反应的产物,是强酸弱碱盐,在溶液中NH4+发生水解反应:NH4++H2O![]() NH3H2O+H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
NH3H2O+H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
(3)Na2CO3是强碱NaOH与弱酸H2CO3发生中和反应的产物,是强碱弱酸盐,在溶液中CO32-发生水解反应:CO32-+H2O![]() HCO3-+OH-,产生的HCO3-会进一步发生水解反应:HCO3-+H2O
HCO3-+OH-,产生的HCO3-会进一步发生水解反应:HCO3-+H2O![]() H2CO3+OH-,当最终达到水解平衡时,溶液中c(OH-)>c(H+),溶液显碱性;
H2CO3+OH-,当最终达到水解平衡时,溶液中c(OH-)>c(H+),溶液显碱性;
(4)FeCl3溶液是强酸HCl与弱碱Fe(OH)3发生中和反应的产物,是强酸弱碱盐,在溶液中Fe3+发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
Fe(OH)3+3H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
(5)CH3COONa是强碱NaOH与弱酸CH3COOH发生中和反应的产物,是强碱弱酸盐,在溶液中CH3COO-发生水解反应:CH3COO-+H2O![]() CH3COOH+OH-,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性。
CH3COOH+OH-,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性。

 阅读快车系列答案
阅读快车系列答案