题目内容
13.下列叙述错误的是( )| A. | 吸热反应的反应物总能量低于生成物总能量 | |
| B. | 绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 | |
| C. | 电力属于一次能源 | |
| D. | 物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
分析 A、依据反应前后能量守恒分析判断反应的能量变化;
B、光合作用是将太阳能转化为化学能的过程;
C、从自然界直接获取没有经过加工转换的能源是一次能源;由一次能源经过加工转换得到的能源是二次能源;
D、人类利用化学能可以转化为电能、热能光能等.
解答 解:A.反应物总能量低于生成物总能量,即反应后物质的总能量增加,则反应为吸热反应,故A正确;
B.绿色植物进行的光合作用是将太阳能转化为化学能“贮存”起来的过程,故B正确;
C.电力不是从自然界直接获的能源,不是一次能源,属于二次能源,故C错误;
D.物质的化学能可以在不同条件下发生反应,如燃料燃烧放出的热量,原电池反应提供电能,镁燃烧发出耀眼的白光,转为热能、电能、光能等为人类所利用,故D正确.
故选C.
点评 本题考查了能源的来源和利用,熟悉能源间的相互转化及转化的方式即可解答,难度不大.

练习册系列答案
相关题目
3.与H2O具有相同电子数的是( )
| A. | F | B. | O2 | C. | CH4 | D. | C2H6 |
4.检验淀粉已完全水解的试剂是( )
| A. | 新制的Cu(OH)2悬浊液 | B. | 碘水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 稀硫酸 |
1.下列叙述中,正确的是( )
| A. | 可将试管、蒸发皿、坩埚直接置于酒精灯火焰上加热 | |
| B. | 将二氧化硫通入到紫色石蕊试液中,试液先变红后褪色 | |
| C. | 用托盘天平称量氢氧化钠固体时,应将固体放在称量纸上 | |
| D. | 容量瓶在使用前用蒸馏水润洗,会影响所配制溶液的浓度 |
8.下列说法正确的是( )
| A. | 按系统命名法 的全称为3-乙基-1-丁烯 的全称为3-乙基-1-丁烯 | |
| B. | 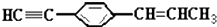 最多有7个碳原子在一条直线上 最多有7个碳原子在一条直线上 | |
| C. | 由2-氯丙烷制取1,2-丙二醇CH2CH(OH)CH2OH时,经过的反应消去→加成→取代 | |
| D. | 蛋白质和油脂都属于高分子化合物,一定条件下能水解 |
18.下列金属中,通常采用热还原法冶炼的是( )
| A. | 钠 | B. | 铁 | C. | 银 | D. | 金 |
5.实验室制取氢气时,应选用的反应物是( )
| A. | 铁和浓硫酸 | B. | 锌和稀硝酸 | C. | 铜和盐酸 | D. | 锌和稀硫酸 |
2.填写下列表格:
| 物质 | 指定的微粒/个 | 质量(m)g | 物质的量(n)mol | 摩尔质量(M)g/mol |
| He | 0.2 | |||
| S | 1.204×1023 | |||
| Na+ | 11.5 | |||
| C6H12O6 | 0.25 |