题目内容
3.A、B、C、D、E、F、G为周期表前四周期的元素,原子序数依次递增.已知①G的原子序数为29,其余均为短周期元素②A原子所处的周期数、族序数与其原子序数相等
③B的基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子数相等
④D的基态原子价电子排布ns2npn+2
⑤E元素所在周期中其基态原子的第一电离能最小
⑥F的单质常温常压下是气体,其基态原子的M层上有一个未成对的p电子.
(1)B、C、E三种元素电负性由大到小的顺序是N>C>Na(用元素符号表示).
(2)C的氢化物分子间能形成氢键,F的氢化物分之间不易形成氢键,原因是Cl的原子半径比N大,N的电负性比Cl大
(3)G的基态原子核外电子排布式为1s22s22p63s23p63d104s1,该元素与元素B、C能形成的离子[G(BC)4]2-中含有的化学键是bd
a.离子键 b.极性键 c.非极性键 d.配位键
(4)A、B、D三种元素组成的一种化合物H是新装修居室中常见的有害气体,它的分子式为BA2D,分子空间构型为平面三角形,该分子中中心原子采取sp2杂化,1molH分子中σ键和π的个数比为3:1
(5)B与C原子结合形成B3C4晶体,其晶体结构与金刚石相似,但比金刚石硬度大,其原因为氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定.
分析 A、B、C、D、E、F、G为周期表前四周期的元素,原子序数依次递增.G的原子序数为29,则G为Cu,其余的均为短周期元素,A原子所处的周期数、族序数与其原子序数相等,则A为H元素;B的基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子数相等,其核外电子排布为1s22s2sp2,故B为C元素;F的单质常温常压下是气体,其基态原子的M层上有一个未成对的p电子,则F为Cl;D的基态原子价电子排布ns2npn+2,由原子序数可知n可能为3,则n=2,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素所在周期中其基态原子的第一电离能最小,原子序数大于氧,故E只能处于第三周期,可推知E为Na,据此解答.
解答 解:A、B、C、D、E、F、G为周期表前四周期的元素,原子序数依次递增.G的原子序数为29,则G为Cu,其余的均为短周期元素,A原子所处的周期数、族序数与其原子序数相等,则A为H元素;B的基态原子电子占据三种能量不同的原子轨道,且每种轨道中的电子数相等,其核外电子排布为1s22s2sp2,故B为C元素;F的单质常温常压下是气体,其基态原子的M层上有一个未成对的p电子,则F为Cl;D的基态原子价电子排布ns2npn+2,由原子序数可知n可能为3,则n=2,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素所在周期中其基态原子的第一电离能最小,原子序数大于氧,故E只能处于第三周期,可推知E为Na.
(1)非金属性越强电负性越大,故电负性:N>C>Na,故答案为:N>C>Na;
(2)Y的氢化物为氨气,R的氢化物为HCl,Cl的原子半径比N大,N的电负性比Cl大,氨气分子间易形成氢键,而HCl分子之间不能形成氢键,
故答案为:Cl的原子半径比N大,N的电负性比Cl大;
(3)G为Cu,其基态原子电子排布式为:1s22s22p63s23p63d104s1,该元素与元素B、C能形成的[Cu(CN)4]2-离子中,含有的化学键为极性键和配位键,
故答案为:1s22s22p63s23p63d104s1;bd;
(4)BA2D为CH2O,呈平面三角形,则C原子采取sp2杂化,1molM分子中σ键和π键的个数比为3:1,
故答案为:sp2;3:1;
(5)C与N原子结合形成的C3N4晶体,其晶体结构与金刚石类似,说明都是原子晶体,但硬度比金刚石大,是因为氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定,
故答案为:氮原子半径小于碳,氮碳形成的共价键键长更短,键能更大,键更稳定.
点评 本题是对物质结构和性质的考查,涉及核外电子排布、电负性、氢键、化学键、杂化方式、晶体类型与性质,难度中等.

| A. | 吸热反应的反应物总能量低于生成物总能量 | |
| B. | 绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 | |
| C. | 电力属于一次能源 | |
| D. | 物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| A. | NaHSO3溶液与NaOH溶液反应:HSO${\;}_{3}^{-}$+OH-=SO${\;}_{3}^{2-}$+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+OH-=HCO${\;}_{3}^{-}$ | |
| C. | Fe与盐酸反应产生H2:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氨水和醋酸溶液混合NH3•H2O+CH3COOH=NH${\;}_{4}^{+}$+H2O |
| A. | NA | B. | 2NA | C. | 3NA | D. | 5NA |
| A. | Fe2O3氧化亚铁 酸性氧化物 | B. | H2SO3硫酸 酸 | ||
| C. | CO2二氧化碳 酸性氧化物 | D. | Na2CO3纯碱 碱 |
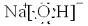 .
.