题目内容
【题目】某研究小组为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,设计并实施了以下实验。
(1)实验1:使用下图装置通过干燥管的增重测量CO2的质量。
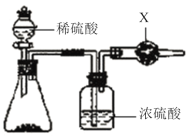
①盛放稀硫酸的仪器名称为________。
②试剂X为________。
③某同学认为装置中干燥管的增重并不能准确表示混合物与稀硫酸反应产生的CO2的质量,其理由是________。
(2)实验2:取a g混合物样品加热、冷却、称重,重复以上操作至固体质量不再变化,测得固体质量变为b g。
①写出加热过程中发生反应的化学方程式________。
②混合物中Na2CO3质量分数为(用a、b表示)________。
【答案】分液漏斗 碱石灰 装置内空气中有CO2;干燥装置的尾端空气中的CO2和水也对碱石灰增重有影响,装置内残余有大量二氧化碳气体 2NaHCO3![]() Na2CO3+CO2↑+H2O 1-
Na2CO3+CO2↑+H2O 1-![]()
【解析】
(1)①根据仪器的结构判断仪器的名称;
②根据CO2是酸性氧化物,可以与碱性物质反应吸收CO2分析;
③从被干燥管中吸收的物质的来源、吸收程度大小分析判断;
(2)①NaHCO3不稳定,受热分解产生碳酸钠、水、二氧化碳;
②减少的质量为反应产生的水、二氧化碳的质量,根据NaHCO3分解产物与反应物的质量关系确定NaHCO3的质量,结合样品总质量计算出Na2CO3的质量,进而可得样品中Na2CO3的质量分数。
(1)①由仪器的结构判断可知盛放稀硫酸的仪器名称为分液漏斗;
②CO2是酸性氧化物,可以与碱性物质发生反应,所以在干燥管中的物质X为碱石灰,用来吸收CO2气体;
③从装置图可知:装置内空气中有CO2会被碱石灰吸收;干燥装置的尾端空气中的CO2和水也会被吸收,对碱石灰增重有影响;同时反应产生的CO2气体会在装置内有残余,而导致不能被干燥管中的物质吸收,都会导致产生误差;
(2)①Na2CO3稳定,受热不分解,而NaHCO3不稳定,受热分解产生碳酸钠、水、二氧化碳,分解反应的方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
②NaHCO3受热分解:2NaHCO3![]() Na2CO3+CO2↑+H2O根据方程式可知:每有168g NaHCO3受热分解,会产生1molH2O、1molCO2,固体质量减小62g,反应前后固体质量减轻(a-b)g,则样品中含有NaHCO3的质量为m(NaHCO3)=
Na2CO3+CO2↑+H2O根据方程式可知:每有168g NaHCO3受热分解,会产生1molH2O、1molCO2,固体质量减小62g,反应前后固体质量减轻(a-b)g,则样品中含有NaHCO3的质量为m(NaHCO3)=![]() ×(a-b)g=
×(a-b)g=![]() g,则样品中Na2CO3的质量为[a-
g,则样品中Na2CO3的质量为[a-![]() ]g,所以Na2CO3和NaHCO3混合物中Na2CO3质量分数为:
]g,所以Na2CO3和NaHCO3混合物中Na2CO3质量分数为: ×100%=1-
×100%=1-![]() 。
。