题目内容
【题目】已知反应X(g) + Y(g) 2Z(g)的能量变化如图所示。下列说法正确的是( )
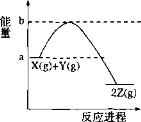
A.1 mol X(g)的能量一定高于1 mol Z(g)的能量
B.该反应一定不需要加热就可以进行
C.升高温度,该反应的正、逆反应速率都加快
D.其他条件不变,若加入催化剂,则反应物的平衡转化率提高
【答案】C
【解析】
A.由能量变化图可知,该反应为放热反应,1molX(g)和1molY(g)的总能量大于1molZ(g)的能量,但不确定1 mol X(g)的能量与1 mol Z(g)的能量高低,故A错误;
B.反应的吸放热与反应的条件无关,放热反应很多需要在一定条件下才能发生,如燃烧反应需要点燃,故B错误;
C.升高温度可以提高活化分子百分数,从而加快反应速率,正、逆速率均会增大,只是增大的程度不同,故C正确;
D.催化剂只影响化学反应速率,对平衡无影响,不能提高平衡转化率,故D错误;
故选:C。

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
【题目】某实验小组研究温度对化学反应H2(g)+I2(g)![]() 2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
2HI(g)的影响,在其他条件相同时,将1molH2(g)、1molI2(g)充入体积为2L的恒容容器中,测得HI(g)的物质的量分数随时间(min)变化的实验数据如下:
时间 | 0 | 20 | 40 | 60 | 80 | 100 | |
HI(g)的物质 的量分数 | T1 | 0 | 0.50 | 0.68 | 0.76 | 0.80 | 0.80 |
T2 | 0 | 0.60 | 0.72 | 0.75 | 0.75 | 0.75 | |
下列说法正确的是( )
A.T1温度下,0~20min之间,H2的平均反应速率为0.025mol·L-1·min-1
B.在T1温度下,该反应有可能在70min时已达到平衡状态
C.T2温度下,20min时的正反应速率大于40min时的逆反应速率
D.由表中数据可知,温度越高,H2(g)与I2(g)的反应限度越大