题目内容
【题目】已如反应:CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=
CH2=CHCH2Cl(g) +HCl(g)。在一定压强下,按ω=![]() 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ) 与温度(T)、ω 的关系,图乙表示逆反应的平衡常数与温度的关系。则下列说法错误的是
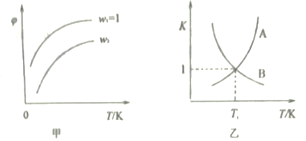
A. 图甲中,ω2>1
B. 图乙中,A线表示逆反应的平衡常数
C. 温度T1、ω=2时,Cl2的转化率为50%
D. 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
【答案】C
【解析】A. 根据图甲中信息可知,增大n(Cl2),ω=![]() 增大,平衡正向移动,丙烯的体积分数(φ)减小,故ω2>1,选项A正确;B. 根据图甲可知,升高温度,丙烯的体积分数增大,说明平衡逆向移动,逆反应为吸热反应,正反应为放热反应,则升高温度,正反应的平衡常数减小,逆反应的平衡常数增大,图乙中,A线表示逆反应的平衡常数,选项B正确;C.由图乙知,温度为T1时,正逆反应的平衡常数相等,又因两者互为倒数,则平衡常数K=1,ω=2时,设CH2=CHCH3和Cl2的物质的量分别为a、2a,参加反应的Cl2的物质的量为b,利用三段式可列关系
增大,平衡正向移动,丙烯的体积分数(φ)减小,故ω2>1,选项A正确;B. 根据图甲可知,升高温度,丙烯的体积分数增大,说明平衡逆向移动,逆反应为吸热反应,正反应为放热反应,则升高温度,正反应的平衡常数减小,逆反应的平衡常数增大,图乙中,A线表示逆反应的平衡常数,选项B正确;C.由图乙知,温度为T1时,正逆反应的平衡常数相等,又因两者互为倒数,则平衡常数K=1,ω=2时,设CH2=CHCH3和Cl2的物质的量分别为a、2a,参加反应的Cl2的物质的量为b,利用三段式可列关系![]() =1,解得
=1,解得![]() =33.3%,Cl2的转化率为33.3%,选项C错误;D. 该反应为前后气体体积不变的放热反应,反应向正反应方向进行,体系温度升高,气体膨胀,达到平衡时,装置内的气体压强将增大,选项D正确。答案选C。
=33.3%,Cl2的转化率为33.3%,选项C错误;D. 该反应为前后气体体积不变的放热反应,反应向正反应方向进行,体系温度升高,气体膨胀,达到平衡时,装置内的气体压强将增大,选项D正确。答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下: CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1
CaO(s)+CO2(g)CaCO3(s)△H=﹣172kJmol﹣1
CO2(g)+4H2(g)CH4(g)+2H2O(g)△H=﹣187kJmol﹣1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式 .
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)CH4(g)+2H2O(g)和CaO(s)+CO2(g)CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
物质 | CO2 | H2 | CaO |
0 | 0.50 | 1.00 | 0.40 |
2 | 0.35 | 0.60 | a |
6 | 0.20 | 0.20 | b |
8 | 0.20 | 0.20 | b |
①反应在0~2min内的平均反应速率v(H2)=
②b=
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2 , CaCO3质量减小 D.充入少量CO2 , c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)CH4(g)+2H2O(g)的化学平衡常数K= . 若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2molL﹣1 NaOH溶液中,下列说法正确的是
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32﹣)>c(OH﹣ )>c(HCO3﹣)>c(H+)
D.c(OH﹣)=2c(H2CO3)+c(HCO3﹣ )+c(H+ )


