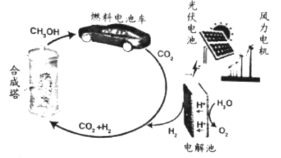
题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
【答案】C
【解析】
该反应中,NaN3为还原剂,KNO3为氧化剂。根据反应方程式为10NaN3+2KNO3=K2O+5Na2O+16N2↑,10molNaN3中的N均化合价升高得到氧化产物N2,根据N原子守恒,氧化产物有15molN2,2molKNO3中的N化合价降低,得到还原产物N2,还原产物有1molN2;可知每生成16molN2,氧化产物比还原产物多了15-1mol=14mol。现氧化产物比还原产物多1.75mol,设生成的N2的物质的量为x,有![]() ,得x=2mol。
,得x=2mol。
A. 计算得生成2mol N2,在标况下的体积为2mol×22.4L·mol-1=44.8L,A正确;
B. KNO3做氧化剂,被还原;生成2mol N2,需要0.25mol KNO3参加反应,B正确;
C. 2molKNO3参加反应转移10mol电子,生成16molN2。现生成2molN2,则有0.25molKNO3参与反应,转移1.25mol电子,C错误;
D. 被氧化的N原子为NaN3中的N原子,0.25mol KNO3参加反应,则有1.25mol NaN3参加反应,所以被氧化的N原子有3×1.25mol=3.75 mol,D正确;
故合理选项为C。

【题目】某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH![]() 、Ba2+、HCO
、Ba2+、HCO![]() 、Cl-B.K+、Al3+、SO
、Cl-B.K+、Al3+、SO![]() 、ClO-
、ClO-
C.Na+、Fe3+、Cl-、SO![]() D.NH
D.NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、NO
、NO![]()
【题目】某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)
②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。

实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
I | 48.0 | 48.0 |
Ⅱ | 48.0 | 44.0 |
Ⅲ | 48.0 | 40.0 |
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。
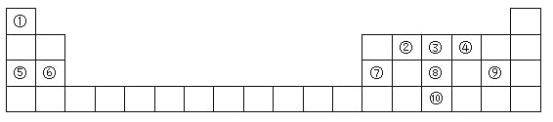
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为___, 其离子结构示意图为:____。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为____。
(3)关于C、D 两种元素说法正确的是_________(填序号)
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
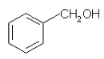
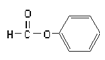
(4)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(5)比较Y元素与其同族短周期元素的氢化物的稳定性 _______(填氢化物化学式),