题目内容
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
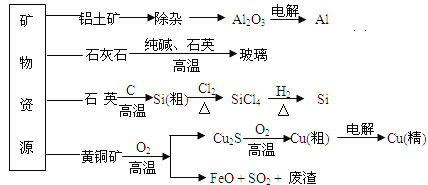
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
【答案】C
【解析】A、根据铝土矿的成分,先加入盐酸,发生Al2O3+6H+=2Al3++3H2O和Fe2O3+6H+=2Fe3++3H2O,然后过滤,向滤液中加入过量的NaOH溶液,发生Al3++4OH-=AlO2-+H2O和Fe3++3OH-=Fe(OH)3↓,过滤,向滤液中通入足量的CO2,发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,氢氧化铝受热分解成氧化铝,然后加入冰晶石,电解熔融状态氧化铝得到金属铝,因此需要用到的物质为NaOH、盐酸、CO2、冰晶石,故A错误;B、石英的成分是SiO2,属于氧化物,且不与盐酸反应,故B错误;C、制取粗硅的反应是:2C+SiO2![]() 2CO+Si,C的化合价升高,即C为还原剂,SiO2中Si的化合价降低,即SiO2作氧化剂,氧化剂与还原剂物质的量之比为1:2,故C正确;D、CuFeS2中S的化合价为-2价,转化成SO2,S的化合价升高,即SO2为氧化产物,故D错误。
2CO+Si,C的化合价升高,即C为还原剂,SiO2中Si的化合价降低,即SiO2作氧化剂,氧化剂与还原剂物质的量之比为1:2,故C正确;D、CuFeS2中S的化合价为-2价,转化成SO2,S的化合价升高,即SO2为氧化产物,故D错误。

 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】以惰性电极电解足量的CuSO4溶液。若阳极上产生气体的物质的量为0.0100 mol,则阴极上析出铜的质量为( )
A. 0.64 g B. 1.28 g C. 2.56 g D. 5.12 g
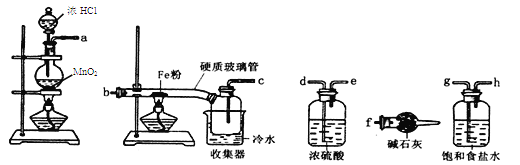
【题目】某兴趣小组用下图所示装置制备气体(酒精灯可以根据需要选择),对应说法正确的是

选项 | ①中药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | C12 | NaOH溶液,尾气吸收 |
B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | Na()H溶液,尾气吸收 |
C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验CO2 |
D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 可撤去 |
A. A B. B C. C D. D
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
(1)该反应的平衡常数表达式K=_____________,△H_________0(填“>”、“<”或“=”)。
(2)要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.恒容加入H2加压
e.恒容加入惰性气体加压
f.分离出甲醇
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是_____(填字母)。
A.c(H2)减少B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
(4)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)= 0.2 mol/L,则CO的转化率为__________,此时的温度为________。以CH3OH表示该过程的反应速率v(CH3OH)=_________mol /(L · min)。