题目内容
【题目】ClO2与Na2S溶液反应的产物中含有Cl-和SO32-,某课外实验小组为了探究两溶液反应的产物中不含SO32-而含有Cl-,设计了如下实验:
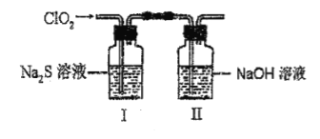
(1)在装置II中NaOH溶液的作用是___,ClO2和NaOH溶液反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出该反应的离子方程式___。
(2)请补充完整实验步骤:把用氮气稀释后的足量ClO2通入I中的Na2S溶液中充分反应,得到无色澄清溶液。
i取少量I中的溶液于试管甲中,滴加品红溶液和盐酸,品红不褪色,证明溶液中无SO2。
ii另取少量I中的溶液于试管乙中,___,证明溶液中含有Cl-。
【答案】吸过量的ClO2,防止空气污染 2ClO2+2OH-=ClO3-+ ClO2-+H2O 向乙中滴加Ba(NO3)2溶液至过量,振荡,静置,取上层清液于试管中,加入足量的稀硝酸酸化的硝酸银溶液,如有白色沉淀生成
【解析】
(1)ClO2有毒,用氢氧化钠收过量的ClO2,防止空气污染;ClO2和NaOH溶液反应生成等物质的量的两种盐,其中一种盐为NaClO2,另外一种为NaClO3,据此写出离子反应方程式;
(2)氯离子的检验常用稀硝酸和硝酸银溶液,若出现白色沉淀,证明氯离子的存在,据此进行分析。
(1)ClO2有毒,用氢氧化钠收过量的ClO2,防止空气污染;ClO2和NaOH溶液反应生成等物质的量的两种盐,其中一种盐为NaClO2,另外一种为NaClO3,离子方程式:2ClO2+2OH-=ClO3-+ ClO2-+H2O;
(2)具体操作为:将用氮气稀释后的足量ClO2通入I中的Na2S溶液中充分反应,得到无色澄清溶液。ii.取少量I中溶液于试管甲中,加入Ba(NO3)2溶液,振荡,如有白色沉淀生成,证明有SO32-;继续向试管乙中滴加Ba(NO3)2溶液至过量,静置,取上层清液于试管中,加入足量的稀硝酸酸化的硝酸银溶液,如有白色沉淀生成,则证明溶液中含有Cl-。

 名校课堂系列答案
名校课堂系列答案【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D