题目内容
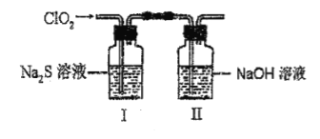
【题目】常温下,将CO2通入1L 0.01 mol·L-1 的某一元碱MOH溶液中,溶液中水电离出的OH-离子浓度[c水(OH-)]与通入的CO2的体积(V)的关系如图所示,下列叙述错误的是

A.MOH为一元强碱
B.b点溶液中:c(H+) = 1×10-7 mol·L-1
C.c点溶液中:c(M+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(M+)=2c(CO32-)+c(HCO3-)
【答案】B
【解析】
a点为MOH溶液,a到c是生成M2CO3,b点是M2CO3和MOH的混合溶液,c点是单一的M2CO3溶液,c到d是生成MHCO3,d点是MHCO3和H2CO3的混合溶液,d点溶液呈中性,据此分析解答。
A.a点为MOH溶液,-lgc水(OH-)=12,c水(H+)=c水(OH-)=10-12 mol·L-1,c溶液(OH-)=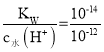 =0.01 mol·L-1,溶液中氢氧根离子浓度与MOH溶液浓度相同,说明MOH在溶液中完全电离,为一元强碱,故A正确;
=0.01 mol·L-1,溶液中氢氧根离子浓度与MOH溶液浓度相同,说明MOH在溶液中完全电离,为一元强碱,故A正确;
B.b点是M2CO3和MOH的混合溶液,溶液显碱性,对水的电离起抑制作用,b点溶液中:c(H+)<1×10-7 mol·L-1,故B错误;
C.c点溶液中,当水电离出的OH-离子浓度最大时,说明此时的溶液是M2CO3溶液,根据M2CO3溶液中的物料守恒可得:c(M+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],故C正确;
D.d点是MHCO3和H2CO3的混合溶液,水电离出的OH-离子浓度10-7 mol·L-1,溶液呈中性,c(H+)=c(OH-),结合电荷守恒c(M+)+c(H+)=2c(CO32-)+c(HCO3-)+c(H2CO3),两式相减得: c(M+)=2c(CO32-)+c(HCO3-),故D正确;
答案选B。

【题目】苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
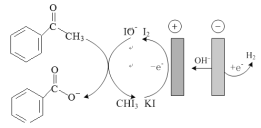
实验步骤如下:
步骤I:电氧化合成
在电解池中加入适量 KI、20mL蒸馏水和20 mL的1,4-二氧六环,搅拌至完全溶解,再加入23.30 mL苯乙酮,连接电化学装置,恒定电流电解3h;
步骤II:清洗分离
反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去亲油性杂质,分离出水相和有机相;
步骤III:制得产品
用浓盐酸酸化水相至pH为1~2,接着加入饱和KHSO3溶液,振荡、抽滤、洗涤、干燥,称量得到产品12.2 g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为___,阳极I-失去电子后的产物与OH-反应的离子方程式为_。
(2)步骤II蒸馏过程中,需要使用到的下图玻璃仪器有_______(填字母),除下图外完成蒸馏操作还需的玻璃仪器______(填仪器名称)。
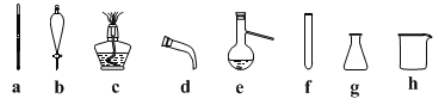
(3)步骤II分液过程中,应充分振荡,静置分层后________(填字母)。
A.依次将有机相、水相从分液漏斗的上口倒出
B.依次将有机相、水相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是_________。
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为___________。
(6)本实验的产率是_________。