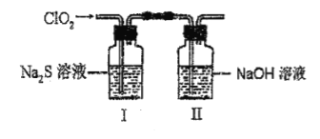
题目内容
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、![]() 等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是
等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量ne。下列说法错误的是

A.反应①②③④均在正极发生
B.④的电极反应式为![]() +10H++8e-=
+10H++8e-=![]() +3H2O
+3H2O
C.单位时间内,三氯乙烯脱去amolCl时ne=amol
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
【答案】C
【解析】
A.由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A项正确;
B.由示意图及元素N的化合价变化可写出如下转化NO3-+8e-→NH4+,由于生成物中有NH4+,所以只能用H+和H2O来配平该反应而不能用H2O和OH-来配平,所以④的电极反应式为![]() +10H++8e-=
+10H++8e-=![]() +3H2O,B项正确;
+3H2O,B项正确;
C.三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol氯原子,所以脱去a mol Cl时ne=2a mol,C项错误;
D.增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,加快ZVI释放电子的速率,可使nt增大,D项正确;
故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:__________.
(2)今有如下两个热化学方程式:则a______b(填“>”、“=”或“<”)
H2(g)+![]() O2(g)=H2O(g)△H1=akJmol-1
O2(g)=H2O(g)△H1=akJmol-1
H2(g)+![]() O2(g)=H2O(l)△H2=bkJmol-1
O2(g)=H2O(l)△H2=bkJmol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
化学键 | H-H | N-H | N≡N |
键能/kJmol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)=2NH3(g)△H=akJmol-1.试根据表中所列键能数据估算a的值:____________(注明“+”或“-”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJmol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJmol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJmol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________.
(5)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g)△H>0,已知该反应在2 404℃,平衡常数K=64×10﹣4.请回答:
①将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____(填字母序号).
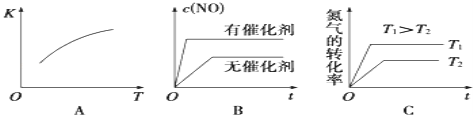
②该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10﹣1 mol/L、4.0×10﹣2 mol/L和3.0×10﹣3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______.
【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。

(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。