题目内容
【题目】检验某溶液中是否含有![]() ,常用的方法是( )
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
【答案】D
【解析】
A. 直接滴加BaCl2溶液不能排除银离子、碳酸根离子、亚硫酸根离子等的干扰,故A错误;
B. 滴加稀盐酸酸化的BaCl2溶液,不能排除银离子的干扰,故B错误;
C. 滴加稀硫酸,再滴加BaCl2溶液,加入的硫酸会与氯化钡生成白色沉淀,不能证明原溶液中是否有SO42存在,故C错误;
D. 先加入稀盐酸,无明显现象,没有产生沉淀,排除银离子、碳酸根、亚硫酸根的干扰,然后再加氯化钡,产生白色沉淀,则证明有SO42存在,故D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
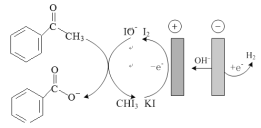
实验步骤如下:
步骤I:电氧化合成
在电解池中加入适量 KI、20mL蒸馏水和20 mL的1,4-二氧六环,搅拌至完全溶解,再加入23.30 mL苯乙酮,连接电化学装置,恒定电流电解3h;
步骤II:清洗分离
反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去亲油性杂质,分离出水相和有机相;
步骤III:制得产品
用浓盐酸酸化水相至pH为1~2,接着加入饱和KHSO3溶液,振荡、抽滤、洗涤、干燥,称量得到产品12.2 g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为___,阳极I-失去电子后的产物与OH-反应的离子方程式为_。
(2)步骤II蒸馏过程中,需要使用到的下图玻璃仪器有_______(填字母),除下图外完成蒸馏操作还需的玻璃仪器______(填仪器名称)。
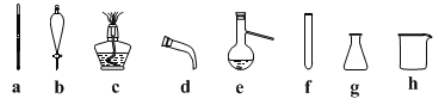
(3)步骤II分液过程中,应充分振荡,静置分层后________(填字母)。
A.依次将有机相、水相从分液漏斗的上口倒出
B.依次将有机相、水相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是_________。
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为___________。
(6)本实验的产率是_________。