题目内容
【题目】(1)请按照系统命名法为下列物质命名:
 ___
___
![]() ___
___
![]() ___
___
(2)请写出2,3—二甲基—4—乙基—2—庚烯的结构简式:___;
(3)请写出由苯制备硝基苯的化学反应方程式___。
(4)某课题组从植物香料中分离出一种罕见的醇(醇A),其结构简式如图。

根据课内所学知识,该醇可发生的反应包括:___(填字母序号)
A.与金属Na反应 B.与CuO反应
C.与氢氧化钠溶液反应 D.消去反应
【答案】3—甲基—1—丁烯 2,4—二甲基己烷 1,3—丁二醇 略 略 AB
【解析】
(1)有机物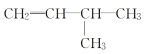 是烯烃,含有1个甲基支链,名称是3—甲基—1—丁烯;有机物
是烯烃,含有1个甲基支链,名称是3—甲基—1—丁烯;有机物![]() 是烷烃,主链含有6个碳原子,名称是2,4—二甲基己烷;有机物
是烷烃,主链含有6个碳原子,名称是2,4—二甲基己烷;有机物![]() 是醇,含有两个羟基,在1号位和三号位,名称是1,3—丁二醇;
是醇,含有两个羟基,在1号位和三号位,名称是1,3—丁二醇;
(2)2,3—二甲基—4—乙基—2—庚烯主链有7个碳原子,两个甲基在2,3位,1个乙基在4号位,碳碳双键在2号位,结构简式为: 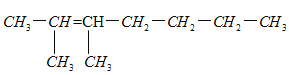 。
。
(3)在催化剂的作用下,苯环上的氢原子硝基子所取代,生成硝基苯,同时有水生成,方程式为: 。
。
(4)羟基与活泼金属或强碱反应生成醇盐,可以和金属Na反应;醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子且与此相邻的碳原子上,并且还必须连有氢原子时,才可发生消去反应,故醇A不能发生消去反应,也不能与氢氧化钠溶液反应;醇A上的羟基具有还原性可以还原CuO,黑色氧化铜变成红色。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:__________.
(2)今有如下两个热化学方程式:则a______b(填“>”、“=”或“<”)
H2(g)+![]() O2(g)=H2O(g)△H1=akJmol-1
O2(g)=H2O(g)△H1=akJmol-1
H2(g)+![]() O2(g)=H2O(l)△H2=bkJmol-1
O2(g)=H2O(l)△H2=bkJmol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
化学键 | H-H | N-H | N≡N |
键能/kJmol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)=2NH3(g)△H=akJmol-1.试根据表中所列键能数据估算a的值:____________(注明“+”或“-”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJmol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJmol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJmol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________.
(5)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g)△H>0,已知该反应在2 404℃,平衡常数K=64×10﹣4.请回答:
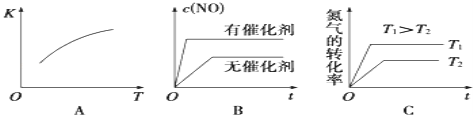
①将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____(填字母序号).
②该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10﹣1 mol/L、4.0×10﹣2 mol/L和3.0×10﹣3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______.