题目内容
【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品
(1)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×104 | Ka1=6.17×108 、Ka2=2.88×1012 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_________pH(NaHN2O2)(填“>”“<”或“=”)。
②25℃时,NaHN2O2溶液中存在水解平衡,其水解常数Kh=____(保留三位有效数字)。
③0.1mol/L NaHN2O2溶液中离子浓度由大到小为:________________________________
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
反应III:H2O(l)![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为__________________。
(3)T1℃时,向容积为2 L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30 g,容器内的压强(p)随时间(t)的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为______________。
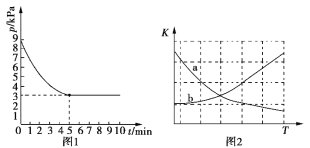
②图2中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
【答案】<1.62×107c(Na+)>c(HN2O2-)>c(OH-)>c(H+)>c(N2O22-)2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) ΔH=87.0 kJ·mol1128(mol/L)-3a
CO(NH2)2(s)+H2O(l) ΔH=87.0 kJ·mol1128(mol/L)-3a
【解析】
(1)①根据“越弱越水解”的规律,可知NaHN2O2的水解程度大于NaNO2,故pH(NaNO2) <pH(NaHN2O2)。
②根据NaHN2O2的水解方程式,可得关系式:Kh=![]() =1.62×107。
=1.62×107。
③由HN2O2-的电离平衡常数Ka2=2.88×1012小于HN2O2-的水解平衡常数Kh =1.62×107,所以NaHN2O2溶液呈碱性,所以NaHN2O2溶液中离子浓度由大到小为:c(Na+)>c(HN2O2-)>c(OH-)>c(H+)>c(N2O22-)。
(2)根据盖斯定律:I式-II式-III式得方程式2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l),则ΔH=159.5 kJ·mol1-116.5 kJ·mol1-44.0 kJ·mol1=87.0 kJ·mol1。
CO(NH2)2(s)+H2O(l),则ΔH=159.5 kJ·mol1-116.5 kJ·mol1-44.0 kJ·mol1=87.0 kJ·mol1。
(3)①尿素的质量为30g,则尿素的物质的量为30g÷60g/mol=0.5mol,因为 n(NH3)∶n(CO2)=2∶1,设n(NH3)为2 a,n(CO2)为a,则根据反应方程式的三段式:
化学反应方程式:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
起始物质的量/mol 2a a 0 0
转化物质的量/mol 1 0.5 0.5 0.5
平衡物质的量/mol 2a1 a0.5 0.5 0.5
恒温恒容条件下,压强之比等于气体物质的量之比,由图像可知:(2 a + a):( 2a1+ a0.5)=9:3,解之得:a=0.75,平衡时c(NH3)=(2 a -1)mol/2L=0.25 mol·L1,c(CO2)=( a0.5)mol/2L =0.125 mol·L1;根据反应可知平衡常数K=![]() =128(mol/L)-3。
=128(mol/L)-3。
②正反应放热,升温平衡向左移动,故平衡常数K减小,故a曲线表。

【题目】1 L某混合溶液,可能含有的离子如下表:
阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
(1)向该溶液中逐滴加入cmol/L NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定含有的离子是______________。
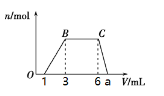
(2)根据图像数据计算a=_______________mL
(3)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | x mol(x≠0) | 0 | 0 |
①当通入Cl2的体积为5.6L时,溶液中发生反应的离子方程式为______________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
③x=_________________mol
【题目】根据下表中部分短周期元素的原子半径及主要化合价信息:
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.152 | 0.143 | 0.160 | 0.102 | 0.074 |
主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
请判断以下叙述正确的是( )
A. 氢化物的沸点为H2T<H2R
B. L+与T2-的核外电子数相等
C. 单质L在空气中燃烧生成的氧化物中,氧元素化合价为-1价
D. M与T形成的二元化合物具有两性