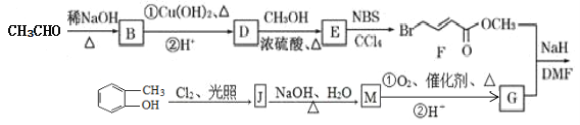
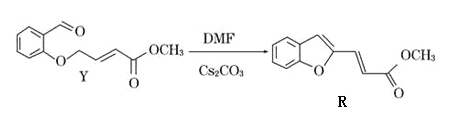
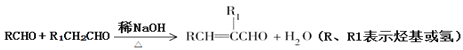题目内容
【题目】氯碱工业所用的精盐由粗盐提纯,粗盐中含有泥沙等不溶性杂质,以及可溶性杂质:Ca2+,Mg2+,SO42-等,提纯的流程如下图:
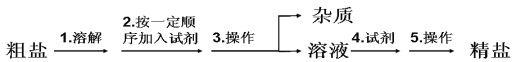
(1)整个流程中所用试剂: ①NaOH溶液、②BaCl2溶液、③Na2CO3溶液、 ④盐酸,下列加入试剂顺序正确的是___________________。
A ①②③④ B ①③②④ C ①②④③ D ②③①④ E ③②①④
除去Mg2+的化学方程式__________________________________________
(2)实验室需配置480mL0.2mol/L的NaCl溶液,用电子天平称取___________g上述精盐,配置时需要的仪器烧杯、玻璃棒外,还需要________________________________。使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是______________(填编号)。
①向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
③转移溶液前容量瓶内有少量蒸馏水
④定容时,仰视容量瓶的刻度线
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
【答案】AD MgCl2+2NaOH==Mg(OH)2↓+2NaCl 5.850 (或5.8500) 500mL容量瓶 胶头滴管 ①②④⑤
【解析】
(1)由实验流程可知,先加水溶解粗盐,向所得溶液中加入过量氢氧化钠溶液除去镁离子,加入过量氯化钡溶液除去硫酸根离子,加入过量碳酸钠溶液除去钙离子和多余的钡离子,注意一定要在加入氯化钡溶液之后加入碳酸钠溶液,过滤,除去不溶性杂质,向滤液中加入盐酸除去溶液中过量的氢氧化钠和碳酸钠,加入稀盐酸后蒸发溶液,即可得到纯净的精盐;
(2)配制溶液时,一般可分为以下几个步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,据此进行排序;注意选用容量瓶的规格要等于或稍大于配制溶液的体积,根据物质的量浓度公式分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)粗盐溶解后,向所得溶液中加入过量氢氧化钠溶液除去镁离子,加入过量氯化钡溶液除去硫酸根离子,加入过量碳酸钠溶液除去钙离子和多余的钡离子,注意一定要在加入氯化钡溶液之后加入碳酸钠溶液,过滤,除去不溶性杂质,向滤液中加入盐酸除去溶液中过量的氢氧化钠和碳酸钠,综上可知加入试剂顺序为①②③④或②③①④;向所得溶液中加入过量氢氧化钠溶液除去镁离子的化学方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl,故答案为:AD;MgCl2+2NaOH==Mg(OH)2↓+2NaCl;
(2)欲配制480mL 0.2mol/L的NaCl溶液,则应配制500mL0.2mol/L的NaCl溶液,所以用电子天平称取氯化钠的质量是0.5L×0.2mol/L×58.5g/mol=5.850g;配制时需要的仪器有烧杯、玻璃棒、500mL容量瓶和胶头滴管;
①向容量瓶中转移溶液时不慎将液滴洒在容量瓶外面,造成氯化钠质量减少,所配溶液的浓度偏低;
②溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,造成氯化钠质量减少,所配溶液的浓度偏低;
③转移溶液前容量瓶内有少量蒸馏水,因不影响溶质的物质的量和溶液的体积,所以对配制溶液的浓度无影响;
④定容时,仰视容量瓶的刻度线,导致溶液的体积偏大,则配制溶液的浓度偏低;
⑤定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,导致溶液的体积偏大,溶液浓度偏低;
所配溶液浓度偏低的是①②④⑤,故答案为:5.850 (或5.8500);500mL容量瓶和胶头滴管;①②④⑤。

【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品
(1)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×104 | Ka1=6.17×108 、Ka2=2.88×1012 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_________pH(NaHN2O2)(填“>”“<”或“=”)。
②25℃时,NaHN2O2溶液中存在水解平衡,其水解常数Kh=____(保留三位有效数字)。
③0.1mol/L NaHN2O2溶液中离子浓度由大到小为:________________________________
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
NH2CO2NH4(s) ΔH1=159.5 kJ·mol1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol1;
反应III:H2O(l)![]() H2O(g) ΔH3=+44.0 kJ·mol1。
H2O(g) ΔH3=+44.0 kJ·mol1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为__________________。
(3)T1℃时,向容积为2 L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30 g,容器内的压强(p)随时间(t)的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为______________。
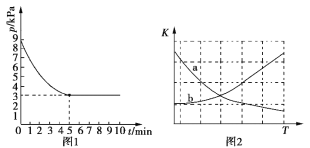
②图2中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。