题目内容
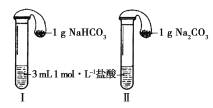
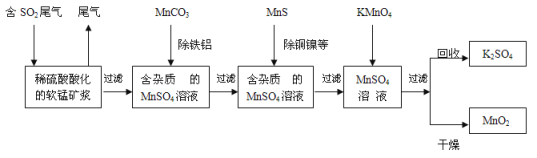
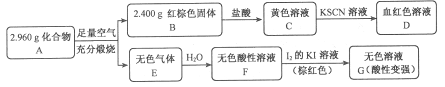
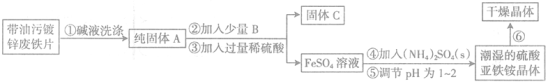
【题目】将A气体通入BaCl2溶液,未见沉淀生成,然后通入B气体,有沉淀生成,再加入过量的稀盐酸后沉淀消失,则A、B气体可能是
A.SO2、H2S B.SO2、NO2 C. CO2 、NH3 D.SO2、Cl2
【答案】C
【解析】
试题分析:A.硫化氢与二氧化硫反应生成单质硫,单质硫不溶于盐酸,故A不选;B.二氧化氮与水反应生成的硝酸将亚硫酸氧化后生成硫酸钡沉淀,不溶于盐酸,故B不选;C.氨气与二氧化碳反应生成碳酸铵,碳酸铵与氯化钡反应生成碳酸钡沉淀,溶于盐酸,故C选;D.氯气将亚硫酸氧化后生成硫酸钡沉淀,不溶于盐酸,故D不选;故选C。

练习册系列答案
相关题目