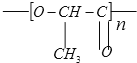题目内容
【题目】【加试题】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
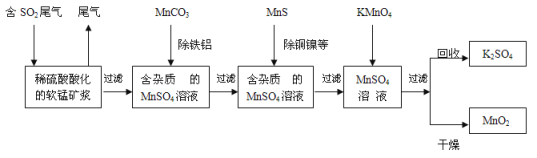
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(3)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH = -520kJ/mol
S(s)+O2(g)=SO2(g) ΔH = -297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH = -1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是 。
(4)MnO2可作超级电容材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是 。
(5)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将5 m3(标准状况)含SO2的体积分数为3 %的尾气通入矿浆,若SO2的脱除率为89.6%,最终每得到MnO2的质量1 kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2 kg。
【答案】(1)AC (2分) (2) MnCO3与H+反应,促进Al3+和Fe3+的水解,使Al3+和Fe3+转化为沉淀除去。(2分)(3) MnO2(s) + SO2(g)=MnSO4(s) ΔH=-248kJ/mol(2分)
(4) Mn2+ + 2H2O-2e―=MnO2+4H+(2分) (5)0.078(2分)
【解析】
试题分析:(1)白色污染主要是塑料等难降解的物质形成的,SO2能形成酸雨,因此脱硫实现了废弃物的综合利用,同时也减少了酸雨形成,答案选AC。
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,反应的离子方程式为:3MnCO3+2Al3+3H2O=2Al(OH)3↓+3CO2↑+3Mn2+或3MnCO3+2Fe3++3H2O=2Fe(OH)3↓+3CO2↑+3Mn2+;
(3)已知:①Mn(s)+O2(g)═MnO2(s)△H=-520kJmol-1
②S(s)+O2(g)═SO2(g)△H=-297kJmol-1
③Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJmol-1
根据盖斯定律可知将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(4)锰离子在阳极失电子,电极反应式为Mn2++2H2O-2e-=MnO2+4H+;
(6)反应的二氧化硫的物质的量为(5000L÷22.4mol/L)×3%×89.6%=6mol,根据SO2+MnO2=MnSO4可知生成硫酸锰的物质的量为6mol,最终生成的二氧化锰为1000g,设消耗硫酸锰的物质的量为x,则
2KMnO4+3MnSO4+2H2O═5MnO2+2H2SO4+K2SO4
3 87×5
x 1000
![]()
解得x=6.9mol
除去铁、铝、铜、镍等杂质时,所引入的锰元素0.9 mol,相当于MnO2的质量0.9mol×87g/mol=78.3g=0.078kg。

 阅读快车系列答案
阅读快车系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
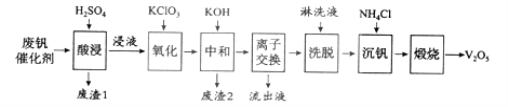
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。