题目内容
6.下列说法正确的是( )| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 把化学反应中物质的变化和反应的焓变同时表示出的化学方程式叫做热化学方程式 | |
| D. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ |
分析 A、书写热化学方程式时,标注物质聚集状态和对应反应的焓变;
B、有些放热反应也需要引发条件才能进行;
C、热化学方程式就是把化学反应中物质的变化和反应的焓变同时表示出的化学方程式;
D、焓变单位为KJ/mol.
解答 解:A、书写热化学方程式时,标注物质聚集状态和对应反应的焓变,故A错误;
B、有些放热反应也需要引发条件才能进行,如氢气和氧气需要点燃才能发生反应,故B错误;
C、热化学方程式就是把化学反应中物质的变化和反应的焓变同时表示出的化学方程式,故C正确;
D、焓变单位为KJ/mol,氢气在氧气中燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,故D错误;
故选C.
点评 本题考查了化学反应能量不变化和反应焓变的理解分析,热化学方程式书写和反应热测定方法是解题关键,题目较简单.

练习册系列答案
相关题目
16.能证明二氧化硅是酸性氧化物的是( )
| A. | 二氧化硅溶于水得到相应的酸 | |
| B. | 二氧化硅是非金属氧化物 | |
| C. | 二氧化硅与强碱溶液反应只生成盐和水 | |
| D. | 二氧化硅与氢氟酸反应 |
1.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 常温常压下,1mol CnH2n+2中所含有的共价键数目为(3n+1)NA |
11.对于任意一个化学平衡体系,采取下列措施,一定会使平衡发生移动的是( )
| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |
16. 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.该反应△S<0(填“>”、“<”或“=”),在低温(填“高温”“低温”或“任何温度”)下能自发进行.
②已知:分别断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,则断裂1mol NO分子中化学键所需要的能量为631.25kJ.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2)=1.88×10-4 mol/(L•s).
②在该温度下,反应的平衡常数K=5000 L/mol.(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明BC (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
④研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据.
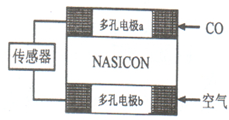
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.
①负极的电极反应式为:CO+O2--2e-═CO2.
②工作时O2-由电极b流向电极a(填a或b)
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5 kJ•mol-1.该反应△S<0(填“>”、“<”或“=”),在低温(填“高温”“低温”或“任何温度”)下能自发进行.
②已知:分别断裂1mol N2、O2分子中化学键所需要的能量是946kJ、497kJ,则断裂1mol NO分子中化学键所需要的能量为631.25kJ.
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
汽车尾气→尾气分析仪→催化反应器→尾气分析仪
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=1.88×10-4 mol/(L•s).
②在该温度下,反应的平衡常数K=5000 L/mol.(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明BC (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
④研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据.
| 实验编号 | T/℃ | NO初始浓度mol•L-1 | CO初始浓度mol•L-1 | 催化剂的比表面积m2•g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①负极的电极反应式为:CO+O2--2e-═CO2.
②工作时O2-由电极b流向电极a(填a或b)
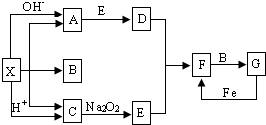 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断: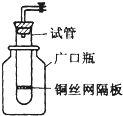 某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.