题目内容
12.某课外实验小组设计的下列实验合理的是( )| A. | 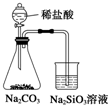 比较非金属性强弱Cl>C>Si | B. | 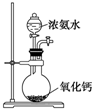 制备少量氨气 | ||
| C. | 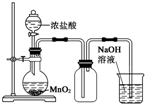 实验室制氯气 | D. | 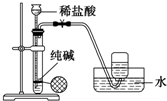 实验室制二氧化碳 |
分析 A.如用酸性强弱比较非金属性,应比较最高价氧化物的水化物的酸性强弱;
B.氨水易挥发,且水和氧化钙反应放出大量的热;
C.应在加热条件下进行;
D.不能用排水法收集.
解答 解:A.比较非金属性,应用最高价氧化物的水化物,这里用高氯酸,且实验没有排出HCl的影响,也不能比较非金属性C>Si,故A错误;
B.氨水易挥发,且水和氧化钙反应放出大量的热,可用于制备少量氨气,故B正确;
C.浓盐酸和二氧化锰在加热条件下反应,故C错误;
D.二氧化碳微溶于水,不能用排水法收集,可用排空气法或排饱和碳酸氢钠溶液,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点和常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质异同以及实验的可行性、严密性的评价,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列有关说法正确的是( )
| A. | 配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 | |
| B. | 可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 | |
| C. | 加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ | |
| D. | 取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
20.下列有关化学用语的表示不正确的是( )
| A. | NaClO的电子式: | |
| B. | 16O的原子结构示意图: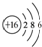 | |
| C. | 质子数为53,中子数为72的碘原子:53125I | |
| D. | 间羟基苯甲醛的结构简式: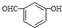 |
17.在水溶液中能大量共存的一组离子是( )
| A. | NH4+、Al3+、NO3-、AlO2- | B. | Na+、Fe3+、HSO3-、OH- | ||
| C. | Cu2+、NH4+、SO42-、Cl- | D. | K+、H+、I-、ClO- |
1.化学用语是学习化学的重要工具.以下化学用语或表述正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 碳正离子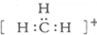 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 | |
| C. | 水合氢离子的结构式为  | |
| D. | NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |
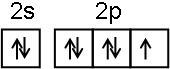 ;NF3中心原子轨道的杂化类型为sp3.
;NF3中心原子轨道的杂化类型为sp3.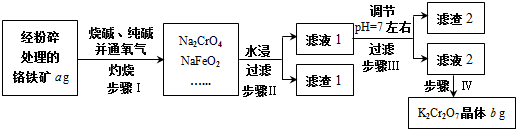
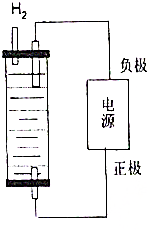 制取漂白粉的氯气通过电解饱和食盐水得到.
制取漂白粉的氯气通过电解饱和食盐水得到.