题目内容
17.已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A. | +262.6 kJ•mol-1 | B. | -131.3 kJ•mol-1 | C. | +131.3 kJ•mol-1 | D. | -352.3 kJ•mol-1 |
分析 依据盖斯定律,制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的△H应由①-②得到,根据盖斯定律来分析.
解答 解:根据①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
依据盖斯定律,①-②得到 C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol;
故选C.
点评 本题考查热化学方程式和运用盖斯定律计算,题目较简单,注意把握盖斯定律的原理,侧重于计算能力的考查.

练习册系列答案
相关题目
7.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98 g•mol-1 | |
| B. | 2mol NO和2mol N2气体体积相等 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
12.下列叙述正确的是( )
| A. | 原子晶体中,共价键的键能越大,熔沸点越低 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 甲烷分子中,键角为109.5° |
2.下列关于物质应用和组成的说法正确的是( )
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | CCl4不可用于鉴别溴水和碘水 | |
| D. | Si和SiO2都用于制造光导纤维 |
9.下列反应中符合图示能量变化的是( )
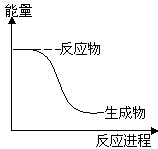

| A. | 电解Al2O3得到Al和O2 | B. | HCl分解为H2和Cl2 | ||
| C. | Al和Fe2O3在高温条件下反应 | D. | Ba(OH)2•8H2O和NH4Cl晶体混合反应 |
6.下列溶液中物质的量浓度为0.2mol/L的是( )
| A. | 将8gNaOH固体溶解于1L水中 | |
| B. | 2gNaOH固体溶解在水中配成250mL溶液 | |
| C. | 将1L2mol/L的浓盐酸与9L水混合 | |
| D. | 将4.48LHCl气体溶于水配成1L溶液 |
3.为了减少温室气体排放,目前工业上采用CO2与H2在催化剂作用下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如表:
根据题目回答下列问题:
(1)平衡时CO2的转化率是25%.
(2)能说明反应已达平衡状态的是BC.
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(3)一定能使该反应的反应速率增大的措施有C.
A.及时分离出产物 B.适当降低温度 C.其他条件不变,增大CO2浓度.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
(1)平衡时CO2的转化率是25%.
(2)能说明反应已达平衡状态的是BC.
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(3)一定能使该反应的反应速率增大的措施有C.
A.及时分离出产物 B.适当降低温度 C.其他条件不变,增大CO2浓度.