题目内容
9.下列反应中符合图示能量变化的是( )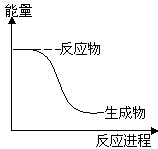
| A. | 电解Al2O3得到Al和O2 | B. | HCl分解为H2和Cl2 | ||
| C. | Al和Fe2O3在高温条件下反应 | D. | Ba(OH)2•8H2O和NH4Cl晶体混合反应 |
分析 从图上分析,反应物能量高于生成物,正反应是放热反应,常见的放热反应有:所有的燃烧反应,金属与酸或水的反应、酸碱中和反应、多数的化合反应等,其△H<0.常见的吸热反应:Ba(OH)2•8H2O与NH4Cl晶体混合反应、水解反应、大多数的分解反应、以C、CO、H2作为还原剂的反应等据此分析.
解答 解:A、电解Al2O3得到Al和O2,是吸热反应,故A错误;
B、HCl分解是吸热反应,故B错误;
C、Al和Fe2O3在高温条件下反应放热,故C正确;
D、Ba(OH)2•8H2O和NH4Cl晶体混合反应是吸热反应,故D错误;
故选C.
点评 本题通过反应物与生成物能量不同判断放热反应和吸热反应,应熟悉常见的放热反应和吸热反应,掌握基础是关键,题目较简单.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
19.工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知:CO(g)+2H2(g)?CH3OH(g)△H=-92.9kJ/mol.一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是( )
| A. | 该反应的△S>0 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 升高温度平衡向逆反应方向移动 |
17.已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A. | +262.6 kJ•mol-1 | B. | -131.3 kJ•mol-1 | C. | +131.3 kJ•mol-1 | D. | -352.3 kJ•mol-1 |
15.下列说法正确的是( )
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 用乙醇作萃取剂可以将碘从碘水中萃取出来 | |
| C. | 乙醇、乙烷和苯都可以与钠反应生成氢气 | |
| D. | 乙醇是一种可再生能源 |

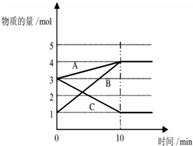 将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.
将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示.