题目内容
【题目】有机物W在工业上常用作溶剂和香料,其合成方法如下:

下列说法正确的是
A. M、N、W均能发生加成反应、取代反应
B. N、W组成上相差一个CH2原子团,所以互为同系物
C. W属于脂肪,能发生皂化反应
D. M的二氯代物有8种
【答案】A
【解析】
甲苯被氧化生成苯甲酸,苯甲酸与甲醇发生酯化反应可生成苯甲酸甲酯。
A.都含有苯环,可发生加成反应,苯环、甲基可发生取代反应,羧基可发生酯化反应,酯基可发生水解反应;
B.N、W含有的官能团不同;
C.油脂在碱性条件下的水解为皂化反应;
D.M的二氯代物,两个Cl原子可在甲基、苯环上,结合位置异构判断。
A.含有苯环,都可发生加成反应,苯环、甲基可发生取代反应,羧基可发生酯化反应,酯基可发生水解反应,水解反应也就是酯的取代反应,A正确;
B.N、W组成上相差一个CH2原子团,但是它们含有的官能团不同,即结构不同,因此不属于同系物,B错误;
C.油脂在碱性条件下的水解为皂化反应,而W是酯,但不是油脂,所以它的水解不是皂化反应,C错误;
D.若取代甲基上的2个H原子,有1种结构;若取代甲基上1个H原子、苯环上1个H原子,则苯环上的Cl原子相对甲基有邻、间、对3种结构;若全部取代苯环上的2个H原子,若其中1个Cl原子与甲基相邻,另一个Cl原子有如图所示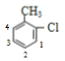 四种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图所示
四种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图所示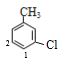 2种取代位置,有2种结构,故甲苯的二氯代物共有1+3+4+2=10种,D错误。
2种取代位置,有2种结构,故甲苯的二氯代物共有1+3+4+2=10种,D错误。
故合理选项是A。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】我国某科研团队以N2为原料合成了超高含能材料聚合氮——以氮氮单键(N-N)结合的具有网状结构的聚合体。有关化学键的键能数据如下:
化学键 | N≡N | N=N | N-N |
键能/(kJ/mol) | 946 | 419 | 159 |
下列分析不正确的是
A. 氮原子的结构示意图:![]() B. 聚合氮转变为N2会释放能量
B. 聚合氮转变为N2会释放能量
C. 高温有利于聚合氮的合成 D. 低压有利于聚合氮的合成




