��Ŀ����
����Ŀ����֪ϡ�����ͭ�ܷ�����Ӧ����������ͭ��һ�����������ˮ��
(1)��д���÷�Ӧ�Ļ�ѧ����ʽ������˫���ŷ������Ӧ�е���ת�Ƶķ������Ŀ��________
(2)һ��ʵ���У�ijͬѧ�ù�����ϡ���ᣨ���ܶ�Ϊ1.08 g��mL-1��HNO3����������Ϊ12%����һ������ͭƬ��Ӧ�������˱�״����0.56 L��һ���������Լ��㣨��Ҫд��������̣���
�ٸ�ϡ��������ʵ���Ũ�ȣ��������С�����һλ����______________
�ڱ���ԭ��HNO3�����ʵ�����________________
���𰸡�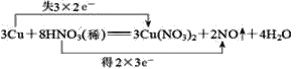 2.1 mol/L 0.025mol
2.1 mol/L 0.025mol
��������
(1)���ݻ�ԭ��ʧȥ���ӣ��������õ����ӣ�����ת����Ŀ��Ԫ�ػ��ϼ�������Ŀ�����ƽ����ʽ������˫���ŷ������Ӧ�е���ת�ƣ�
(2)�ٸ���c=![]() �������ʵ���Ũ�ȣ�
�������ʵ���Ũ�ȣ�
��HNO3����ԭ����NO������Nԭ���غ㣬��NO�����ʵ����ɼ��㱻��ԭ��HNO3�����ʵ�����
(1)ϡ�����ͭ�ܷ�����Ӧ����������ͭ��һ�����������ˮ����Ӧ����ʽΪ3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O���÷�Ӧ�в���NԪ�ػ��ϼ���+5�۱�Ϊ+2�ۣ�������ΪHNO3����Ӧ��ԭ����ΪNO��CuԪ�ػ��ϼ���0�۱�Ϊ+2�ۣ���ԭ��ΪCu���÷�Ӧת��6e������˫���ű���÷�Ӧ����ת�Ƶķ������ĿΪ ��
��
(2)�ٸ������ʵ���Ũ��������������ϵʽ�ɵø���Һ�����ʵ���Ũ��c=![]() mol/L��2.1mol/L��
mol/L��2.1mol/L��
���ڷ�Ӧ3Cu+8HNO3(ϡ)=3Cu(NO3)2+2NO��+4H2O��HNO3����ԭ����NO��NO�ڱ�״�������Ϊ0.56 L��n(NO)= ![]() =0.025 mol������NԪ���غ��֪����ԭ��HNO3�����ʵ���Ϊ0.025 mol��
=0.025 mol������NԪ���غ��֪����ԭ��HNO3�����ʵ���Ϊ0.025 mol��

 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�����Ŀ����������ʵ��������������õ��Ľ�����ȷ����( )
ѡ�� | ʵ����������� | ���� |
A | �ýྻ�IJ�˿պȡijʳ���������ھƾ��ƻ��������գ������Ի�ɫ | ˵����ʳ���������� |
B |
|
|
C | ��ij��Һ�еμ� | ��Һ�к� |
D | ��ʯ��������ͨ�����ȵ����Ƭ�ֽ�õ�������ͨ��������Ȼ�̼��Һ��������Ȼ�̼��Һ��ɫ | �ֽ�����к���ϩ |
A.AB.BC.CD.D
����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ c ��ˮϡ�� d �������������ƾ���
��2���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��3����֪��Ԫ������ˮ��Һ�еĵ����Ƿֲ����еģ��ҵ�һ���ĵ���̶ȴ��ڵڶ����ĵ���̶ȣ��ڶ����ĵ���̶�Զ���ڵ������ĵ���̶���������HA��H2B��H3C�������ᣬ��������ǿ�� + �������� = ��ǿ���� + ���������ķ�Ӧ���ɣ�����֮���ܷ������з�Ӧ��
a.HA + HC2-(����) = A-+ H2C-
b.H2B(����) + 2A- = B2- + 2HA
c.H2B(����) + H2C- = HB-+ H3C
�ش��������⣺
����ͬ�����£�HA��H2B��H3C�������У�������ǿ����_____________��
�����з�Ӧ�����ӷ���ʽ��ȷ����____________��
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
��������з�Ӧ�����ӷ���ʽ��
a.H3C + OH-(����)����__________________��b.HA(����) + C3- ����_____________________��