题目内容
【题目】NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol1
C(s) + O2(g) = CO2(g) ΔH2 = 393.5kJ·mol1
2C(s) + O2(g) =2CO(g) ΔH3 =221.0kJ·mol1
(1)某反应的平衡常数表达式为K=![]() , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
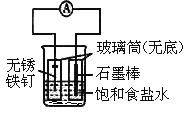
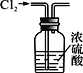
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的离子方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

(5)2SO3(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。

【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1 acd S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH- S2O
+OH- S2O![]() +Cl2+5H2O=2 SO
+Cl2+5H2O=2 SO![]() +8Cl-+10H+ HSO
+8Cl-+10H+ HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+或SO
+3H+或SO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +2H+ c
+2H+ c ![]() 向逆反应方向移动
向逆反应方向移动
【解析】分析:本题是化学反应原理的综合试题。几个小题之间互相没有关联,所以只需要对每个问题咨询分析计算即可。
详解:(1)根据反应的平衡常数的表达式得到反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),将第一和第三个方程式乘以-1,第二个方程式乘以2,相加得到:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1。
N2(g)+2CO2(g),将第一和第三个方程式乘以-1,第二个方程式乘以2,相加得到:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH =-746.5 kJ·mol1。
(2)恒容下,压强不变就是气体的物质的量不变,该反应是气体物质的量减小的反应,所以压强不变可以证明平衡态,选项a正确。速率比应该等于方程式的系数比,所以v正(CO)= 2v逆(N2)才是正确说法,选项b错误。该反应中所有物质都是气体,所以m总不变,如果平均分子量不变,得到气体的n总不变(![]() ),该反应是气体物质的量减小的反应,所以n总不变是平衡态,选项c正确。平衡常数只与温度有关,平衡常数不变就是温度不变,该容器绝热,如果有吸热或者放热温度一定变化,现在温度不变,说明反应达平衡,既没有吸热也没有放热,选项d正确。开始冲入的NO和CO是相等的,反应中两者按照1:1进行反应,所以容器中两者恒定相等,选项e错误。
),该反应是气体物质的量减小的反应,所以n总不变是平衡态,选项c正确。平衡常数只与温度有关,平衡常数不变就是温度不变,该容器绝热,如果有吸热或者放热温度一定变化,现在温度不变,说明反应达平衡,既没有吸热也没有放热,选项d正确。开始冲入的NO和CO是相等的,反应中两者按照1:1进行反应,所以容器中两者恒定相等,选项e错误。
(3)Na2S2O3溶液显碱性的原因一定是硫代硫酸根离子水解,注意水解分步,方程式为:S2O![]() +H2O
+H2O![]() HS2O
HS2O![]() +OH-。根据反应过程的图示,加入氯化钡后得到的白色沉淀一定是硫酸钡,说明氯水将硫代硫酸根离子氧化为硫酸根离子,所以反应为:S2O
+OH-。根据反应过程的图示,加入氯化钡后得到的白色沉淀一定是硫酸钡,说明氯水将硫代硫酸根离子氧化为硫酸根离子,所以反应为:S2O![]() +Cl2+5H2O=2 SO
+Cl2+5H2O=2 SO![]() +8Cl-+10H+。
+8Cl-+10H+。
(4)用亚硫酸钠溶液吸收二氧化硫应该得到亚硫酸氢钠溶液,将亚硫酸氢钠溶液(pH=6的吸收液)加入电解槽中。右侧是电解的阴极,可以认是水电离的氢离子得电子转化为氢气,剩余的氢氧根离子与亚硫酸氢根离子反应得到亚硫酸根离子。左侧是电解的阳极,c为阴离子交换膜,亚硫酸氢根离子透过交换膜进入阳极,在阳极上失电子专户为硫酸根,副产物甲为硫酸。所以阳极反应为:HSO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +3H+或SO
+3H+或SO![]() +H2O-2e-=SO
+H2O-2e-=SO![]() +2H+(溶液中也有一定量的亚硫酸根)。
+2H+(溶液中也有一定量的亚硫酸根)。
(5)假设加入的SO3为2mol,平衡转化率为40%,所以反应的SO3为0.8mol,生成的SO2为0.8mol,O2为0.4mol,达平衡时有:1.2molSO3、0.8molSO2、0.4molO2;恒容下容器的压强比等于气体的物质的量的比,所以平衡时压强为:(1.2+0.8+0.4)P0/2=1.2P0。分压=总压×物质的量分数,所以SO3分压为:(1.2/2.4)×1.2P0=0.6P0;SO2分压为:(0.8/2.4)×1.2P0=0.4P0;O2分压为:(0.4/2.4)×1.2P0=0.2P0;所以KP=![]() 。题目要求判断再加入等物质的量SO2和SO3,平衡的移动方向,因为没有说明加入的量,所以是加入任意量应该得到相同结果,所以可以假设某确定值,带入进行计算。仍然按照上述计算,加入2molSO3平衡时有:1.2molSO3、0.8molSO2、0.4molO2。假设再加入SO2和SO3各自1.2mol,此时物质的量为:2.4molSO3、2molSO2、0.4molO2(一共4.8mol气体)。所以此时压强为4.8P0/2=2.4P0。SO3分压为:(2.4/4.8)×2.4P0=1.2P0;SO2分压为:(2/4.8)×2.4P0=P0;O2分压为:(0.4/4.8)×2.4P0=0.2P0;所以QP=
。题目要求判断再加入等物质的量SO2和SO3,平衡的移动方向,因为没有说明加入的量,所以是加入任意量应该得到相同结果,所以可以假设某确定值,带入进行计算。仍然按照上述计算,加入2molSO3平衡时有:1.2molSO3、0.8molSO2、0.4molO2。假设再加入SO2和SO3各自1.2mol,此时物质的量为:2.4molSO3、2molSO2、0.4molO2(一共4.8mol气体)。所以此时压强为4.8P0/2=2.4P0。SO3分压为:(2.4/4.8)×2.4P0=1.2P0;SO2分压为:(2/4.8)×2.4P0=P0;O2分压为:(0.4/4.8)×2.4P0=0.2P0;所以QP=![]() ,反应向逆反应方向移动。
,反应向逆反应方向移动。

【题目】硝酸是一种重要的化工原料,工业上采用氨的催化氧化法制备硝酸。
(1) 已知反应N2(g)+3H2(g) 2NH3(g)为放热反应,在恒容容器中能说明该反应达到平衡状态的是(_______)
A.容器内N2、H2、NH3的浓度之比为1:2:3
B. v正(N2)=v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
(2)理论上,为了增大平衡时的转化率,可采取的措施是_____________(要求答出两点)
⑶合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下表,则400℃时,测得某时刻氮气、氢气、氨气的物质的量浓度分别为1 mol·L-1、2 mol·L-1、3 mol·L-1时,此时刻该反应正反应速率_____ 逆反应速率(填“大于”、“小于”或“等于”)
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
(4)消除硝酸工厂尾气的一种方法是用甲烷催化还原氮氧化物,已知:
① CH4 (g)+2O2(g)=CO2(g)+2H2O(g) △ H=-890.3 kJ·mol-1
② N2(g)+2O2(g)=2NO2(g) △ H=-67.0 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为___________________________________________
(5)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式),当两种沉淀共存时,溶液中C(Mg2+)/C(Cu2+)=_________(已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)