题目内容
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
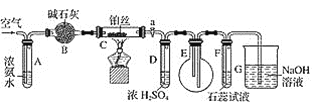
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含 |
B |
|
|
C | 向某溶液中滴加 | 溶液中含 |
D | 将石蜡油蒸气通过炽热的碎瓷片分解得到的气体通入溴的四氯化碳溶液,溴的四氯化碳溶液褪色 | 分解产物中含乙烯 |
A.AB.BC.CD.D
【答案】C
【解析】
A.钾的焰色反应被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃,则实验中不能确定是否有![]() ,A错误;
,A错误;
B.二氧化硅与氢氟酸反应为其特性,二氧化硅为酸性氧化物,B错误;
C.氨气能使湿润的红色石蕊试纸变蓝,通过现象可知,溶液中滴加氢氧化钠溶液并加热产生氨气,说明溶液中含![]() ,C正确;
,C正确;
D.不饱和烃能使溴的四氯化碳溶液褪色,由现象可知,分解产物中含有不饱和烃,但不一定为乙烯,D错误;
答案选C。

【题目】异丁烯![]() 是一种重要的化工原料,可由异丁烷
是一种重要的化工原料,可由异丁烷![]() 直接催化脱氢制备:
直接催化脱氢制备:
(1)已知:![]()
![]()
写出由异丁烷![]() 催化脱氢制备异丁烯
催化脱氢制备异丁烯![]() 的热化学方程式。_________。
的热化学方程式。_________。
(2)一定条件下,以异丁烷为原料催化脱氢生产异丁烯。温度、压强的改变对异丁烷平衡转化率的影响如图所示。

①判断![]() 、
、![]() 的大小关系:
的大小关系:![]() _____________
_____________![]() (填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
(填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
a.升高温度 b.降低温度 c.增大压强 d.降低压强 e.使用催化剂
②平衡常数的表达式中的平衡浓度可以用平衡时各气体的分压代替(气体a的分压=气体a的物质的量分数×总压强,即![]() (总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数
(总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数![]() _____________(保留两位有效数字)。
_____________(保留两位有效数字)。
(3)温度对催化剂的活性和目标产物的选择性都有一定的影响。下表是以![]() 为催化剂,在反应时间相同时,测得的不同温度下的数据。
为催化剂,在反应时间相同时,测得的不同温度下的数据。
温度/℃ | 550 | 570 | 590 | 610 | 630 |
异丁烷转化率/% | 13.8 | 24.5 | 25.6 | 30.0 | 33.3 |
异丁烯选择性/% | 93.9 | 88.3 | 95.0 | 80.4 | 71.2 |
异丁烯的产率/% | 12.9 | 21.6 | w | 24.1 | 23.7 |
已知①选择性![]() ;②异丁烷高温下裂解生成短碳链烃类化合物
;②异丁烷高温下裂解生成短碳链烃类化合物
①590℃时异丁烯的产率![]() _____________×100%。
_____________×100%。
②在590℃之前异丁烯的产率随温度升高而增大的原因可能是____________、_____________。
③590℃之后,异丁烯产率降低的主要原因可能是_____________。
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
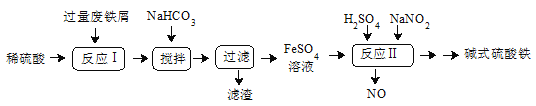
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.0 | 5.9 | 3.7 |
完全沉淀 | 3.5 | 8.4 | 4.7 |
请回答下列问题:
(1)该工艺中“搅拌”的作用是__,写出反应I中发生氧化还原反应的离子方程式__。
(2) “滤渣”的主要成分是__(填化学式),加入适量NaHCO3的目的是调节pH在__范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为__,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量__g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)![]() 聚合离子,该水解反应的离子方程式为__。
聚合离子,该水解反应的离子方程式为__。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-==2Fe2++I2、2![]() +I2==2I-+
+I2==2I-+![]()
则溶液中铁元素的总含量为__g·L-1。