题目内容
【题目】醇烃化新技术是近几年合成氨工业净化精炼原料气,除去少量CO一种新方法,其原理可分为甲醇化与甲烷化两个部分。
甲醇化:![]()
![]()
甲烷化:![]()
![]()
![]() 下列措施有利于提高醇烃化过程CO转化率的是________。
下列措施有利于提高醇烃化过程CO转化率的是________。
A.及时分离出![]() 适当升高反应温度
适当升高反应温度
C.使用高效的催化剂 ![]() 适当增大压强
适当增大压强
![]() 甲醇化平衡常数可用
甲醇化平衡常数可用![]() 表示,
表示,![]() 为平衡组分中各物质的物质的量分数。若CO与
为平衡组分中各物质的物质的量分数。若CO与![]() 混合原料气中CO的体积分数为
混合原料气中CO的体积分数为![]() ,经甲醇化后CO的平衡转化率为w,则
,经甲醇化后CO的平衡转化率为w,则![]() ________
________![]() 用含w的表达式来表示
用含w的表达式来表示![]() 。
。
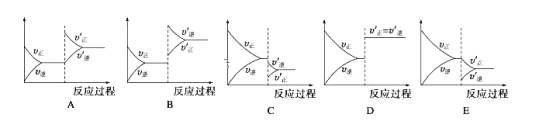
![]() 测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:
测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:

从上图可知选择哪种催化剂较好________![]() 填a或
填a或![]() ,理由是________。
,理由是________。
![]() 下列关于醇烃化过程说法正确的是________。
下列关于醇烃化过程说法正确的是________。
A.甲醇化与甲烷化过程在任何条件下均为自发反应
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量
C.当温度与反应容器体积一定时,在原料气中加入少量的惰性气体,有利于提高平衡转化率与甲醇的产率
D.适当增大混合气体中![]() 的百分含量,有利于提高醇烃化过程CO平衡转化率
的百分含量,有利于提高醇烃化过程CO平衡转化率
【答案】![]()
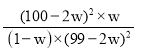
![]() b催化剂达到较高催化效率时的压强小,达到较高催化效率温度低且受温度影响小
b催化剂达到较高催化效率时的压强小,达到较高催化效率温度低且受温度影响小 ![]()
【解析】
(1)A.及时分离出CH3OH,减小生成物浓度,平衡正方向移动;
B.反应为放热反应,升高反应温度,平衡逆向移动;
C.催化剂不影响化学平衡;
D.适当增大压强,平衡正向移动;
(2)CO与H2混合原料气中CO的体积分数为1%,设参与反应的CO为1mol,则H2为99mol,经甲醇化后CO的平衡转化率为w,列三段式:
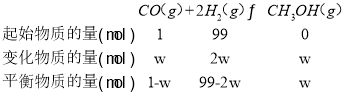
根据a=![]() ,Kα=
,Kα=![]() 代入可得;
代入可得;
(3)根据图选择催化效率高的同时压强温度小的催化剂;
(4)A.根据△G=△H-T△S判断;
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量;
C.恒温恒容时,加入惰性气体,不影响化学反应速率;
D.适当增大混合气体中H2的百分含量,平衡正方向移动。
(1)A.及时分离出CH3OH,平衡正方向移动,CO转化率增大,故A正确;
B.反应为放热反应,升高反应温度,平衡逆向移动,CO转化率减小,故B错误;
C.使用高效的催化剂,催化剂不影响化学平衡,故C错误;
D.反应为气体体积减小的反应,适当增大压强,平衡正向移动,CO转化率增大,故D正确;
故答案为:AD;
(2)CO与H2混合原料气中CO的体积分数为1%,设参与反应的CO为1mol,则H2为99mol,经甲醇化后CO的平衡转化率为w,列三段式:
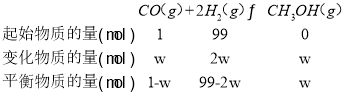
根据a=![]() ,Kα=
,Kα=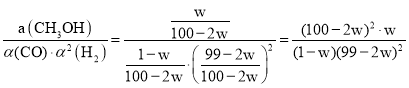 ;
;
(3)由图可知,b催化剂达到较高催化效率时的压强小,达到较高催化效率温度低且受温度影响小,故选择b催化剂;
(4)A.甲醇化与甲烷化过程的△H<0,△S<0,温度较低时,△G=△H-T△S<0,反应能自发进行,故A错误;
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量,故B正确;
C.当温度与反应容器体积一定时,在原料气中加入少量的悄性气体,化学反应速率不变,平衡不移动,平衡转化率与甲醇的产率不变,故C错误;
D.适当增大混合气体中H2的百分含量,平衡正方向移动,有利于提高醇烃化过程CO平衡转化率,故D正确;
故答案为:BD。

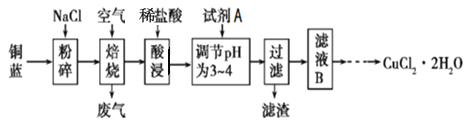
【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:
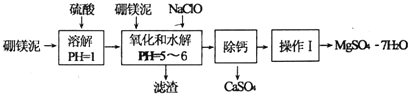
已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
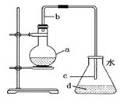
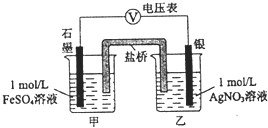
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______
【题目】盐卤中除含有Mg2+、Cl﹣外,还含有少量Na+、Fe2+、Fe3+、SO42﹣和CO(NH2)2等.从海水提取食盐和Br2后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,制备流程如图所示:
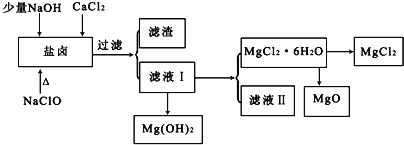
(1)从MgCl2溶液得到MgCl2.6H2O晶体的过程中所需的基本操作顺序依次为__________;
A 加热蒸馏 B 加热浓缩 C 冷却结晶 D 趁热过滤 E 过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是___________(用适当的文字结合化学用语说明).
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为___________;加入NaClO的另一个作用是___________.
(4)Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。
已知25℃时Ksp[Mg(OH)2]=5.6×10﹣12,且Mg(OH)2(s)═MgO(s)+H2O(s)△H=+81.5kJ/mol。
①下列叙述正确的是______
A.从盐卤或海水中获得Mg(OH)2,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成MgO覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________.