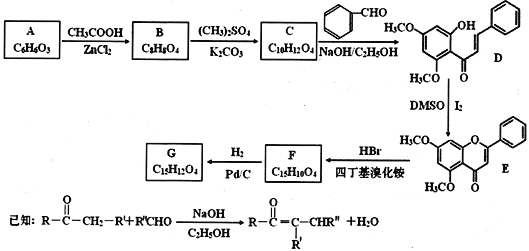
题目内容
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:

(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
【答案】富集溴元素 C 3 3 1 5 3
【解析】
由流程可知,海水晒盐得到NaCl、卤水(含溴离子),电解NaCl生成氯气,氯气与卤水发生氧化还原反应生成溴,利用纯碱吸收发生3Br2+3CO32-=BrO3-+5Br-+ 3CO2↑,酸性条件下溴酸根离子和溴离子发生氧化还原反应得到溴单质,然后蒸馏可得到工业溴。
(1)步骤Ⅰ中已获得游离态的溴的含量较低,步骤Ⅱ又将之转化为化合态的溴,其目的是富集溴元素;
(2)步骤Ⅱ通入热空气吹出Br2,是利用了溴单质易挥发的性质,故合理选项是C;
(3)Br元素的化合价由0升高为+5价,Br元素的化合价由0降低为-1价,由电子、电荷守恒及原子守恒可知,离子方程式为:3Br2+3CO32-=BrO3-+5Br-+ 3CO2↑,化学计量数分别是3;3;1;5;3。

 阅读快车系列答案
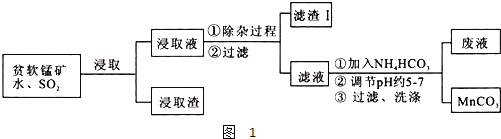
阅读快车系列答案【题目】某研究性学习小组在网上收集到如下信息:以贫软锰矿和有色金属冶炼厂的![]() 废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为
废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为![]() 和少量
和少量![]() 、
、![]() 、
、![]() 等杂质.工艺流程如图1:
等杂质.工艺流程如图1:
已知:有关氢氧化物沉淀pH对应表
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
氢氧化铁 |
|
|
氢氧化铝 |
|
|
氢氧化亚铁 |
|
|
请回答:
![]() 在浸出液除杂过程中需通入适量空气并调节溶液的pH到
在浸出液除杂过程中需通入适量空气并调节溶液的pH到![]() ,沉淀部分杂质离子,此时滤渣I中主要含有 ______
,沉淀部分杂质离子,此时滤渣I中主要含有 ______ ![]() 填化学式
填化学式![]() .
.
![]() 影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质
影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质![]() 造成锰损失.温度对浸锰率的影响见图2、图3.
造成锰损失.温度对浸锰率的影响见图2、图3.
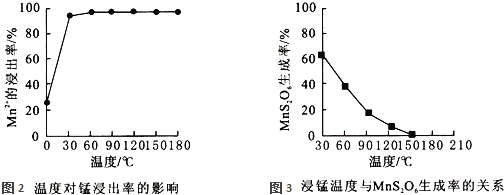
为了提高锰的浸出率,请选择合适的条件 ______ ![]() 填序号
填序号![]()
![]() 以上
以上
![]() 在滤液中加入
在滤液中加入![]() 生成
生成![]() 的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______
的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______ ![]() 若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
![]() 现有含锰质量分数为
现有含锰质量分数为![]() 的贫锰矿1吨,若按照上述工艺锰的产率为
的贫锰矿1吨,若按照上述工艺锰的产率为![]() ,最终获得碳酸锰的质量 ______ .
,最终获得碳酸锰的质量 ______ .
【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:

已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
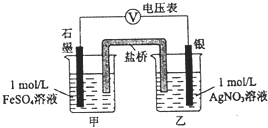
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。