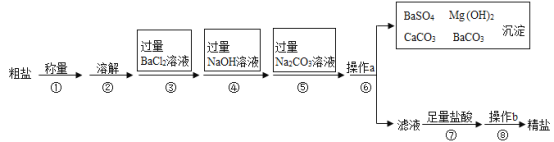
题目内容
【题目】Fe3+与SO32-不能大量共存的原因是存在氧化还原反应和双水解反应之争。如图是利用手持技术测量向FeCl3溶液滴加Na2SO3溶液过程中的pH和电导率的变化情况:
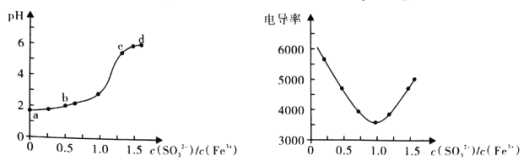
实验过程还发现:
i.b点时溶液澄清透明,向其中分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和灰绿色难溶物;
ii.c点和d点均出现明显红褐色难溶物,取上层清液,分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和无明显变化。
结合以上信息,下列分析不合理的是
A.a点溶液在配置时需加入盐酸
B.结合b点附近pH的变化以及实验现象,说明此处发生了氧化还原反应
C.c点溶液中发生的主要反应为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3
D.取d点处上层清液,向其中滴加K3[Fe(CN)6],溶液会出现蓝色沉淀
【答案】D
【解析】
A.Fe3+易水解,则配制FeCl3溶液溶液时,常加入盐酸,抑制水解Fe3+,故A正确;
B.b点时溶液澄清透明,向其中分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和灰绿色难溶物,说明b点溶液中含有Fe2+和Fe3+,其中Fe2+为Fe3+的还原产物,则说明发生氧化还原反应,故B正确;
C.c点出现明显红褐色难溶物,且上层清液中,分别加入KSCN溶液和NaOH溶液,现象分别为出现血红色和无明显变化,说明红褪色沉淀为Fe(OH)3,溶液中无Fe2+,则此时发生反应的化学方程式为2Fe3++3SO32-+6H2O=2Fe(OH)3↓+3H2SO3,故C正确;
D.d点上层清液中加入NaOH溶液,无明显变化,说明d点溶液中无Fe2+,则滴加K3[Fe(CN)6],不会出现蓝色沉淀,故D错误;
故答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目