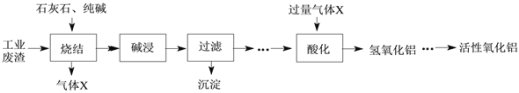
题目内容
【题目】用下图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠固体小颗粒
C. 棉球处发生的化学反应是: Cl2+2NaOH=NaCl+NaClO+H2O
D. 可在棉球右侧用湿润的淀粉碘化钾试纸判断氯气是否被碱液完全吸收
【答案】A
【解析】
由信息可知,钠着火燃烧,生成大量白烟,发生氯气与Na的反应生成NaCl,钠燃烧生成过氧化钠与二氧化碳反应,氯气有毒,可利用碱液吸收,且氯气具有氧化性,以此来解答。
A.钠燃烧时火焰为黄色,故A错误;
B.氯气与Na的反应生成NaCl,则反应生成的大量白烟是氯化钠晶体,故B正确;
C.氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故C正确;
D.氯气具有氧化性,存在剩余氯气时与KI反应生成碘单质,碘遇淀粉变蓝,所以可据其颜色变化判断氯气是否被碱液完全吸收,故D正确;
故答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目