题目内容
【题目】已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
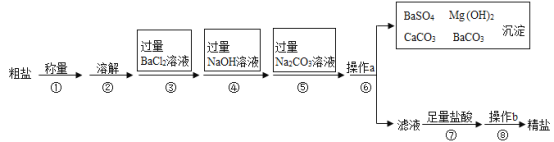
(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是 ___________________________
(5)第⑥步操作a的名称是 ________,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________,此步操作中产生气泡的化学方程式是___________________。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________
【答案】B BaCl2+Na2SO4 =BaSO4↓+2NaCl MgCl2+2NaOH=Mg(OH)2↓+ 2NaCl 除尽Ca2+和过量的Ba2+ 过滤 三层滤纸 除尽过量的OH-和CO32- Na2CO3+2HCl=2NaCl+H2O+CO2 防止局部温度过高使液体飞溅
【解析】
(1)根据左盘总质量=右盘总质量+游码读数;
(2)第③步滴加BaCl2溶液,与Na2SO4作用生成BaSO4沉淀;
(3) 根据加入过量氢氧化钠溶液的目的是除去氯化镁进行解答;
(4)第⑤步操作滴加过量Na2CO3溶液后有CaCO3和BaCO3沉淀生成;
(5)第⑥步操作的目的是固液分离;
(6)根据在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3进行解答;
(7) 根据蒸发结晶过程中玻璃棒的作用进行解答。
(1) 砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,则砝码是5g、游码读数是0.4g,根据左盘总质量=右盘总质量+游码读数,可知粗盐的质量=5g-0.4g=4.6g,故答案为B;
(2) 第③步滴加BaCl2溶液,与Na2SO4作用生成BaSO4沉淀,发生反应的化学方程式是BaCl2+Na2SO4 =BaSO4↓+2NaCl;
(3) 第④步操作中加入过量氢氧化钠溶液的目的是除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(4) 第⑤步操作加入过量的碳酸钠溶液,能除去氯化钙和过量的氯化钡,故其目的是除去氯化钙和过量的氯化钡;
(5) 过滤用于分离难溶性固体和可溶性固体的方法,第⑥步操作a的名称是过滤,此步操作中,玻璃棒的末端要轻轻地斜靠在三层滤纸的一边;
(6) 在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3,其中与Na2CO3反应时的方程式为Na2CO3+2HCl=2NaCl+H2O+CO2;
(7) 蒸发结晶过程中玻璃棒的作用:防止蒸发时因局部温度过高,造成液滴飞溅。

【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正