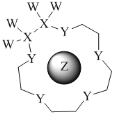
��Ŀ����
����Ŀ����̬������(HNO2��HONO)�Ǵ����е�һ����Ⱦ�
(1)������ĵ���ƽ�ⳣ��Ka��6.0��10��6������뷽��ʽΪ________��
(2)����������и�ԭ���������Ӿ��ﵽ�ȶ��ṹ�������ʽΪ________��
(3)��������������������װ�[(CH3)2NH]Ѹ�ٷ�Ӧ���������᰷[CH3)2N��N��O]�������᰷������Ҫ�Ļ�ѧ�°���֮һ��
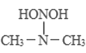
�� ����������װ���Ӧ���������᰷��һ�ַ�Ӧ�������£�
HONO+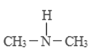
![]()
![]()
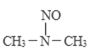
���̢����̢��ķ�Ӧ���ͷֱ�Ϊ��________����ȥ��Ӧ��
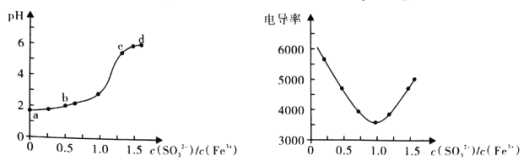
�� ������Ӧ�����ķ�Ӧ�����������仯�Ĺ�ϵ��ͼ��
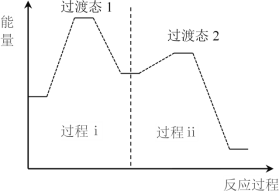
����������װ���Ӧ���������᰷�ķ�Ӧ��H________0(����������������)����Ӧ�Ѷȸ�����ǹ���________(����������������)��
���𰸡�HNO2 H+��NO2�� ![]() �ӳɷ�Ӧ �� ���̢�
�ӳɷ�Ӧ �� ���̢�
��������
(1)��������ĵ��볣������ֵ��֪������һ��һԪ���
(2)���������ڹ��ۻ�����ݴ���д����ʽ��
(3)������������к��е���˫�����������ķ�Ӧ��������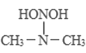 ����˫����ʧ����Ϊ������������������
����˫����ʧ����Ϊ������������������ ����ȥһ���ǻ�����ԭ�ӣ��γɵ���˫��������л���ķ�Ӧ���ͷ�����
����ȥһ���ǻ�����ԭ�ӣ��γɵ���˫��������л���ķ�Ӧ���ͷ�����
�ڸ��ݸ�˹���ɷ�������ѧ��Ӧ����ЧӦֻ����ʼ������״̬�йأ���仯;���ط����жϣ����Խ��Ӧ���е�Խ������Ӧ�Ѷ�Խ��
(1)��������ĵ��볣������ֵ��֪������һ��һԪ���ᣬ����Һ�в��ֵ��룬���뷽��ʽΪHNO2 H+��NO2����
(2)���������ڹ��ۻ���������и�ԭ���������Ӿ��ﵽ�ȶ��ṹ�������ʽΪ![]() ��
��
(3)������������к��е���˫�������̢��ķ�Ӧ�������� ����˫����ʧ����Ϊ�������������Կ���
����˫����ʧ����Ϊ�������������Կ���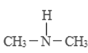 �еĵ�������ѣ��ֱ�ӳ�����������ӵĵ���˫�����ˣ����Կ����Ǽӳɷ�Ӧ�����̢���
�еĵ�������ѣ��ֱ�ӳ�����������ӵĵ���˫�����ˣ����Կ����Ǽӳɷ�Ӧ�����̢��� ����ȥһ���ǻ�����ԭ�ӣ��γɵ���˫�������Կ����л���Ӧ�д��ǻ�����ȥ��Ӧ��
����ȥһ���ǻ�����ԭ�ӣ��γɵ���˫�������Կ����л���Ӧ�д��ǻ�����ȥ��Ӧ��
�ڸ��ݸ�˹���ɷ�������ѧ��Ӧ����ЧӦֻ����ʼ������״̬�йأ���仯;���أ�����ͼʾ����Ӧ�����������������������������÷�Ӧ���ڷ��ȷ�Ӧ����H��0�������ָ���Ӵӳ�̬ת��Ϊ��������ѧ��Ӧ�Ļ�Ծ״̬(����̬)����Ҫ�����������Խ��Ӧ���е�Խ������Ӧ�Ѷ�Խ����ͼʾ�����̢��Ļ�ܴ��ڹ��̢��Ļ�ܣ�����̢��ķ�Ӧ�Ѷȸ���

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�