题目内容
【题目】碳酸铈[Ce2(CO3)3]是制备稀土发光材料、汽车尾气净化催化剂的重要原料。碳酸铈可由铈的氯化物和碳酸氢铵反应制备。甲同学利用下列装置模拟制备Ce2(CO3)3:
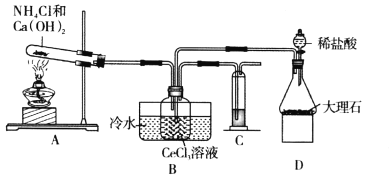
已知:i.装置C中溶液为亚硫酸钠溶液;
ii.Ksp[Ce2(CO3)3]=1.00×10-28;
iii.Ce3+易被空气氧化成Ce4+。
(1)装置D中盛放稀盐酸的实验仪器名称为________,装置C中溶液的作用是________。
(2)装置A中发生的化学反应方程式为________。
(3)实验装置中有一处不合理,请针对不合理之处写出改进措施:________。
(4)装置B中制备Ce2(CO3)3反应的离子方程式为________。
(5)实验过程中当Ce3+沉淀完全时![]() ,溶液中
,溶液中![]() 为________。
为________。
(6)Ce2(CO3)3在装置B中沉淀,然后经过静置、过滤、洗涤、干燥后即可得到产品。检验产品是否洗涤干净的方法为________。
(7)为测定产品中Ce2(CO3)3的纯度,取![]() 产品加入稀硫酸、
产品加入稀硫酸、![]() 溶液至全部溶解,配成
溶液至全部溶解,配成![]() 溶液,取
溶液,取![]() 溶液用
溶液用![]() 的
的![]() 溶液滴定至终点(铈被还原成Ce3+),消耗
溶液滴定至终点(铈被还原成Ce3+),消耗![]() 溶液
溶液![]() ,则产品中Ce2(CO3)3的纯度为________。
,则产品中Ce2(CO3)3的纯度为________。
【答案】分液漏斗 防止空气中的氧气进入装置B中氧化Ce3+ 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体 2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O 10-6mol/L 取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净 92.00%
CaCl2+2H2O+2NH3↑ 装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体 2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O 10-6mol/L 取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净 92.00%
【解析】
碳酸铈可由铈的氯化物和碳酸氢铵反应生成Ce2(CO3)3,则装置A中生成的NH3通入盛装CeCl3溶液的广口瓶中时,同时要通入过量装置D中制得的CO2,方可制得Ce2(CO3)3;操作过程中需要注意除去CO2中混有的HCl,洗涤Ce2(CO3)3时只要最后一次洗涤液中检验不到Cl-即为洗涤干净。
(1)装置D中盛放稀盐酸的实验仪器名称为分液漏斗,装置C中溶液为亚硫酸钠溶液,有较强还原性,能防止空气中的氧气进入装置B中氧化Ce3+;
(2)装置A是制氨气,发生的化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3) CO2中混有的HCl,需要在装置BD之间连接饱和碳酸氢钠溶液,吸收挥发出来的HCl气体;
(4)装置B中CeCl3溶液和碳酸氢铵反应生成Ce2(CO3)3,发生反应的离子方程式为2Ce3++6HCO3-=Ce2(CO3)3↓+3CO2↑+3H2O;
(5)已知Ksp[Ce2(CO3)3]=c2(Ce3+)×c3(CO32-)=1.00×10-28,且c (Ce3+)=1×10-5mol/L,则![]() =
=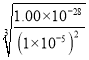 mol/L=1×10-6mol/L;
mol/L=1×10-6mol/L;
(6)最初沉淀Ce2(CO3)3的洗涤液中含有Cl-,当取最后一次洗涤后的滤液少许于试管中,加入少量硝酸银溶液,如无沉淀产生,则证明已经洗涤干净;
(7)已知滴定时发生反应为Ce4++Fe2+=Ce3++Fe3+,消耗![]() 的
的![]() 溶液20.00mL,即参加反应的Fe2+的物质的量为0.02L×0.10mol/L=2×10-3mol,则产品中Ce2(CO3)3的纯度为
溶液20.00mL,即参加反应的Fe2+的物质的量为0.02L×0.10mol/L=2×10-3mol,则产品中Ce2(CO3)3的纯度为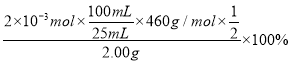 =92.00%。
=92.00%。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案