题目内容
12.做电解水实验时,为了增强水的导电能力,可以加入的试剂是( )| A. | CuSO4 | B. | KCl | C. | KOH | D. | K2SO4 |
分析 溶液中离子浓度越大其导电能力越强,做电解水实验时,为了增强水的导电能力,加入的物质不能放电,只有水中氢离子和氢氧根离子放电,据此分析解答.
解答 解:A.如果加入硫酸铜时,阴极上铜离子放电而不是氢离子放电,所以不能加入硫酸铜,故A错误;
B.加入KCl时,阳极上氯离子放电而不是氢氧根离子放电,所以不能加入KCl,故B错误;
C.加入KOH时,阳极上氢氧根离子放电、阴极上氢离子放电,且能增强溶液导电能力,符合条件,故C正确;
D.加入硫酸钾时,阳极上氢氧根离子放电、阴极上氢离子放电,且能增强溶液导电能力,符合条件,故D正确;
故选CD.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,为高频考点,熟练掌握阴阳离子放电顺序,题目难度不大.

练习册系列答案
相关题目
3.同周期的A、B、C三元素,其最高价氧化物水化物的酸性由弱到强的顺序是:H3CO4<H2BO4<HAO4,则下列判断正确的是( )
| A. | 主族序数按A、B、C的顺序依次减小 | |
| B. | 非金属性 A>B>C | |
| C. | 气态氢化物的稳定性按A、B、C的顺序由弱到强 | |
| D. | 原子半径 A>B>C |
4. 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
( )
 已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是
已知:25℃时某些弱酸的电离平衡常数(如表),如图图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=4.7×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(HR)×c(O{H}^{-})}{c({R}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.8 g N2与C2H4的混合气体中含有的电子数为1.4NA | |
| B. | 标准状况下,1.12L NO与1.12L O2的混合物中含有的原子数为0.2NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 常温下,1L 0.1mol/L 的NH4NO3溶液中氧原子数为0.3NA |
2.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 醋酸与NaHCO3溶液反应:H++HCO3-═CO2↑+H2O | |
| C. | 向KI溶液中加入FeCl3溶液:Fe3++2I-═Fe2++I2 | |
| D. | 将铝片加入烧碱溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
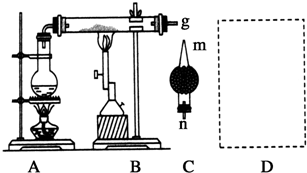
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.
 .
. .
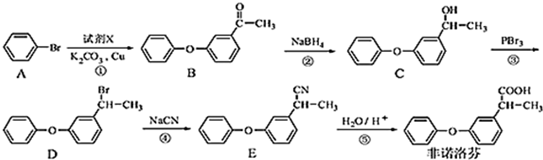
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.