题目内容
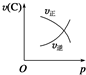
20. 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH$\stackrel{醇}{→}$CH2=CH2↑+NaBr+H2O
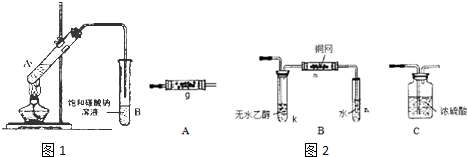
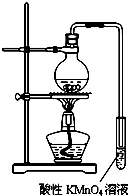
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象.一段时间后,观察到酸性KMnO4溶液颜色褪去.
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色.
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:在小试管之前增加一个盛有冷水的洗气瓶.
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显.该小组再次查阅资料,对实验进行进一步的改进.
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%.
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快.
资料三:溴乙烷的沸点:38.2℃.
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是反应温度较低,此时发生反应的化学方程式为:CH3CH2Br+NaOH$\stackrel{55℃}{→}$CH3CH2OH+NaBr.
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是①冷凝管(或者用较长的导气管).②量程为200℃温度计.
分析 (1)从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙醇和乙烯都能使酸性KMnO4溶液颜色褪色;
(2)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明生成乙烯了;
(3)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%不难分析原因;
(4)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
解答 解:(1)因为乙醇具有挥发性,所以从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙烯和乙醇都可以使酸性KMnO4溶液颜色褪去,故不一定是产生的乙烯,
故答案为:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;
(2)根据(1)的分析,只要在通入酸性KMnO4溶液之前除去乙醇就可以证明生成乙烯了,除去乙醇最简单的方法就是通入水中而且又不影响乙烯;
故答案为:在小试管之前增加一个盛有冷水的洗气瓶;
(3)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%,所以应该是反应温度较低主要发生了取代反应,方程式为:CH3CH2Br+NaOH$\stackrel{55℃}{→}$CH3CH2OH+NaBr;
故答案为:反应温度较低;CH3CH2Br+NaOH$\stackrel{55℃}{→}$CH3CH2OH+NaBr;
(5)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
故答案为:冷凝管(或者用较长的导气管);量程为200℃温度计.
点评 本题主要考查了探究溴乙烷的消去反应的条件并验证产物,正确分析题干信息为解答关键,注意掌握物质性质实验方案的设计原则,试题侧重考查学生的分析、理解能力及综合应用所学知识的能力,难度中等.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | 黄砷的熔点高于白磷 | B. | 黄砷中共价键键能大于白磷 | ||
| C. | 黄砷分子极性大于白磷 | D. | 分子中共价键键角均为109°28′ |
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②向新制的H 2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
| ④镁带与2molL -1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2molL -1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
(1)实验目的:验证第三周期元素从左到右金属性递减、非金属性递增的规律.
(2)实验仪器:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等;
(3)实验内容:请将实验方案与实验现象一一对应(*填写题给信息表中的序号),写出化学方程式
| 实验方案* | 实验现象* | 有关化学方程式 |
(5)请用结构理论简单说明具有上述结论的原因.
(6)请你补充一组事实,说明此周期中另外两种元素的性质递变规律.
| A. | 属卤族元素 | B. | 属第17族元素 | C. | 属非金属元素 | D. | 有放射性 |
| A. | CuSO4 | B. | KCl | C. | KOH | D. | K2SO4 |