题目内容
13.利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功,其流程如下: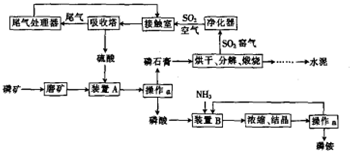
回答下列问题:
(1)操作a的名称是过滤,制硫酸工艺中净化SO2窑气的目的是防止SO2气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
(2)装置B中生成两种酸式盐,它们的化学式分别是(NH4)2HPO4、NH4H2PO4.
(3)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾,能用于测定硫酸尾气中SO2含量的是CD(填字母).
A.NaOH溶液、酚酞试液 B.氨水、酚酞试液
C.碘水、淀粉溶液 D.KMnO4溶液、稀H2SO4
处理尾气常用氨水吸收后再加稀硫酸处理,放出的SO2经干燥后进入接触室循环利用,尾气中SO2被吸收以及再放出SO2所发生的有关反应的化学方程式分别为SO2+2NH3•H2O=(NH4)2SO3+H2O、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O.
(4)水泥广泛应用于土木建筑、水利、国防等工程,是非常重要的无机非金属材料,工业生产普通硅酸盐水泥的主要原料是石灰石和黏土,水泥中加入少量石膏的作用是调节水泥的硬化速度.
(5)硫酸是基础化学工业的重要产品和原料,用硫酸可制备多种硫酸盐,现有一种硫酸盐的化学式可表示为Fe2(SO4)3•x(NH4)2SO4•yH2O,为确定其组成,称取该硫酸盐2.410g,加入过量的NaOH溶液并加热,生成的气体用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,再将等质量的该硫酸盐荣誉水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀2.330g,该硫酸盐的化学式为Fe2(SO4)3•(NH4)2SO4•24H2O.
分析 (1)操作a是把固体与液体分开,应为过滤;接触室中净化气体可以防止催化剂中毒;
(2)装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4;
(3)SO2、微量的SO3和酸雾都能与碱反应,不能利用碱测定,SO2具有还原性,可以利用强氧化剂测定;尾气中SO2被氨水吸收生成(NH4)2SO3和水,(NH4)2SO3再H2SO4反应生成(NH4)2SO4和SO2,据此写出方程式;
(4)生产普通硅酸盐水泥的原料是石灰石和黏土;水泥中加入石膏可以提高水泥的硬化速度;
(5)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(304+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{304+132x+18y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量即=$\frac{2.41}{304+132x+18y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.05mol,据此列式①;
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{304+132x+18y}$×(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g中所含的SO42-的物质的量相等,据此列式②,两式联立即可解得.
解答 解:(1)分离固体和液体的方法是过滤,即操作a的名称为过滤;接触室中净化SO2气体可以防止催化剂中毒;故答案为:过滤;防止SO2气体中的灰尘、水蒸气等在接触室中导致催化剂中毒;
(2)装置a中磷酸与氨气发生反应,磷酸是三元酸,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4三种盐,其中(NH4)2HPO4、NH4H2PO4两种酸式盐.
故答案为:(NH4)2HPO4;NH4H2PO4;
(3)A、NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B、氨水NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故B错误.
C、硫酸尾气中只有SO2能被碘水氧化SO2,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D、硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故D正确;
尾气中SO2被氨水吸收生成(NH4)2SO3和水,化学方程式为:SO2+2NH3•H2O=(NH4)2SO3+H2O;(NH4)2SO3再H2SO4反应生成(NH4)2SO4和SO2:(NH4)2SO3+H2SO4=(NH4)2SO4+SO2+H2O,故答案为:CD;SO2+2NH3•H2O=(NH4)2SO3+H2O,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(4)生产普通硅酸盐水泥的原料是石灰石即CaCO3和黏土;水泥中加入石膏可以提高水泥的硬化速度,故答案为:石灰石和黏土;调节水泥的硬化速度;
(5)Fe2(SO4)3•x(NH4)2SO4•yH2O的摩尔质量为(400+132x+18y)g/mol,则2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的NH4+的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,加入过量的NaOH溶液并加热,生成的NH3的物质的量n=$\frac{2.41}{400+132X+18Y}$×2xmol,生成的氨气用100mL0.0500mol•L-1硫酸吸收,再用0.2000mol•L-1的NaOH溶液滴定,生成正盐时消耗NaOH溶液25.00mL,故NH3消耗的H+的物质的量n=0.1L×0.05mol/L×2-0.025L×0.2mol/L=0.005mol,而根据反应NH3+H+=NH4+可知:$\frac{2.41}{400+132X+18Y}$×2xmol=0.005mol ①
2.410gFe2(SO4)3•x(NH4)2SO4•yH2O中含有的SO42-的物质的量n=$\frac{2.41}{400+132X+18Y}$(3+x)mol,与BaCl2溶液反应生成白色BaSO4沉淀2.330g,而2.33gBaSO4沉淀中所含的SO42-的物质的量n=$\frac{2.33g}{233g/mol}$=0.01mol,故有:$\frac{2.41}{400+132X+18Y}$×(3+x)mol=0.01mol ②
将①②联立可解得:x=1,y=24,即该硫酸盐的化学式为Fe2(SO4)3•(NH4)2SO4•24H2O.
故答案为:Fe2(SO4)3•(NH4)2SO4•24H2O.
点评 本题考查了工业尾气的处理的方法和化学方程式的书写以及化学式的求解,综合性较强,难度较大.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 煤的气化、液化和干馏是物理变化 | |
| B. | 通过石油分馏得到的汽油是纯净物 | |
| C. | 石油裂解是为了得到乙烯、丙烯等气态短链烃 | |
| D. | 干馏的产物能提取出苯、甲苯等芳香烃,因为煤中含有苯和甲苯 |
| A. | 1mol/L | B. | 10mol/L | C. | 0.01mol/L | D. | 0.1mol/L |
| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | X在自然界中以游离态和化合态形式存在 |
| A. | 标准状况下,22.4LSO3含有NA个分子 | |
| B. | 标准状况下,22.4LCO2与CO的混合气体含NA个分子 | |
| C. | lmolNa2O2与足量CO2反应转移的电子数为2NA | |
| D. | 常温下NA个H2分子的质量约为2g,它所占的体积约为22.4L |
| A. | 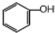 和 和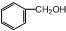 | B. | 丙烷和2,2一二甲基丙烷 | ||
| C. | 乙二醇和丙三醇 | D. | 1,1一二氯乙烷和1,2一二氯乙烷 |

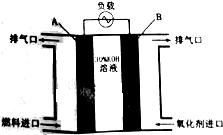 CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.
CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.