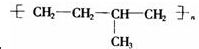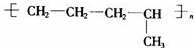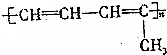题目内容
3. CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.
CO、H2、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ.(1)相同质量的以上四种燃料,完全燃烧时放出热量最多的是H2;
(2)甲烷完全燃烧放出的热量是445.15kJ,反应中转移电子的物质的量为4mol;
(3)已知断开1mol CO、1mol O2中的化学键,需要消耗的能量分别为1075kJ、496kJ,则形成1molCO2(g)中的化学键释放的能量为1606kJ;
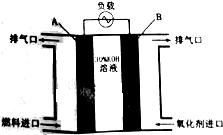
(4)氢氧燃料电池已用于航天飞机,其构造如图所示,则A极为电池的负(填“正”或“负”)极,电池的总反应式为2H2+O2=2H2O.
分析 (1)根据CO、H2、CH4、C2H5OH的相对分子质量分别为28、2、16、46和每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ,计算1gCO、H2、CH4、C2H5OH完全燃烧时,放出热量进行比较;
(2)根据1molCH4完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为890.3kJ,即转移4-(-4)=8mol电子进行计算;
(3)根据一氧化碳的燃烧热结合焓变等于反应物的键能之和-生成物的键能之和进行计算;
(4)氢氧燃料电池燃料为负极,氧气为正极,总反应即燃烧反应.
解答 解:(1)CO、H2、CH4、C2H5OH的相对分子质量分别为28、2、16、46,又因为它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283.0kJ、285.8kJ、890.3kJ、1366.8kJ,所以1gCO、H2、CH4、C2H5OH完全燃烧时,放出热量分别为:$\frac{283}{28}$,$\frac{285.8}{2}$,$\frac{890.3}{16}$,$\frac{1366.8}{46}$,则相同质量的以上四种燃料,完全燃烧时放出热量最多的是H2,故答案为:H2;
(2)由题意,1molCH4完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为890.3kJ,即转移4-(-4)=8mol电子,所以甲烷完全燃烧放出的热量是445.15kJ,反应中转移电子的物质的量为$\frac{445.15}{890.3}$×8=4mol,故答案为:4;
(3)由题意,1molCO完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为283kJ,又焓变等于反应物的键能之和-生成物的键能之和,所以设形成1molCO2(g)中的化学键释放的能量为xKJ,则-283=1075+$\frac{1}{2}$×496-x,解得x=1606KJ,故答案为:1606;
(4)氢氧燃料电池燃料为负极,氧气为正极,所以A极为电池的负极,总反应即燃烧反应即2H2+O2=2H2O,故答案为:负;2H2+O2=2H2O.
点评 本题考查学生有关热化学方程式的计算知识以及燃料电池的原理,可以根据所学知识来回答,难度不大.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案①温度和体积一定,某一物质浓度不再变化时 ②温度和体积一定,容器内压强不再变化时
③条件一定,混合气体的平均相对分子质量不再变化时 ④温度和体积一定,混合气体的颜色不再变化时 ⑤温度和压强一定,混合气体的密度不再变化时 ⑥2v正(NO2)=v逆(N2O4)
⑦单位时间内生成2x mol NO2的同时消耗x mol N2O4.
| A. | ①②③④⑤ | B. | ②③④ | C. | ①②③⑥ | D. | ③④⑤⑦ |
| A. | 电池工作时,电子由铝板沿导线流向铂网 | |
| B. | 铂电极做成网状,可增大与氧气的接触面积 | |
| C. | 正极反应为:O2+H2O+2e-═2OH- | |
| D. | 该电池通常只需要更换铝板就可继续使用 |
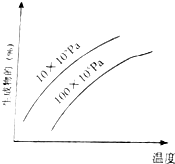 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )| A. | 反应物中一定有气体 | B. | 生成物中不一定有气体 | ||
| C. | 正反应一定是放热反应 | D. | 正反应一定是吸热反应 |
| A. | n个氧气分子 | B. | 2n个硝酸分子 | ||
| C. | 4n个水分子 | D. | 4n个二氧化碳分子 |
 发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:
发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答: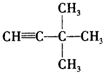 :3,3-二甲基-1-丁炔;
:3,3-二甲基-1-丁炔;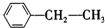 :乙苯.
:乙苯.