题目内容
18.W,X,Y,Z是短周期元素,其部分性质如表,下列说法正确的是( )| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | X在自然界中以游离态和化合态形式存在 |
分析 W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的$\frac{2}{3}$,若Y处于第二周期,令最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×$\frac{2}{3}$=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,结合元素周期律与元素化合物性质解答.
解答 解:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的$\frac{2}{3}$,若Y处于第二周期,令最外层电子数为a,则(2+a)×$\frac{2}{3}$=a,解得a=4,为碳元素,若Y处于第三周期,令最外层电子数为a,则(2+8+a)×$\frac{2}{3}$=a,解得a=20,不符合题意,故Y为碳元素;Z是第三周期原子半径最小的金属,则Z为Al,
A.非金属性S>Si,故氢化物稳定性H2S>SiH4,故A错误;
B.X为Si、Y为C,非金属性C>Si,故最高价氧化物对应水化物的酸性:Y>X,故B正确;
C.S2-离子比Al3+多一个电子层,故离子半径S2->Al3+,故C错误;
D.X为Si,在自然界中以化合态形式存在,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
9. 反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
 反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )| A. | > | B. | = | ||
| C. | < | D. | 条件不足,无法判断 |
6.下表列出部分化学键的佳能:
据此判断下列说法正确的是( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最稳定的共价键是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根据表中数据能计算出SiCl4(g)+2 H2(g)═Si(s)+4 HCl(1)的△H |
3.白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验中的( )
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③确定蛋壳是否含碳酸钙 ④检验食盐中是否加碘.
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ③确定蛋壳是否含碳酸钙 ④检验食盐中是否加碘.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
7.下列关于电池的叙述正确的是( )
| A. | 丢弃的废电池不会造成污染 | |
| B. | 锌锰干电池负极锌在工作时失去电子 | |
| C. | 氢氧燃料电池是将热能直接转化为电能 | |
| D. | 二次电池的充电过程是将化学能转化成电能的过程 |
8.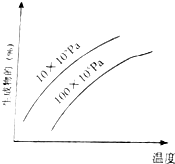 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
 由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )| A. | 反应物中一定有气体 | B. | 生成物中不一定有气体 | ||
| C. | 正反应一定是放热反应 | D. | 正反应一定是吸热反应 |