题目内容
【题目】德裔美籍固体物理学家古迪纳夫在研究钴酸锂LiCOO3)。磷酸亚铁锂(LiFePO4)等正极材料及锂离子电池领域作出卓著贡献而获得2019年诺贝尔化学奖,其中磷酸亚铁锂(LiFePO4)是一种新型汽车理离子电池,总反应为FePO4+Li![]() LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
A.充电时,铁元素发生还原反应
B.放电时,Li作负极
C.放电时,正极反应为FePO4+Li++e-=LiFePO4
D.若用该电池电解饱和食盐水(电解池电极均为情性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为1.4g
【答案】A
【解析】
A.根据总反应可知,充电时Fe元素由+2价变为+3价,失电子化合价升高,发生氧化反应,A错误;
B.由放电时原电池原理知,负极反应为Li 失电子(Li-e-=Li+) 发生氧化反应,B正确;
C.放电时,FePO4在正极得到电子发生还原反应生成LiFePO4,电极反应为FePO4+Li++e-=LiFePO4,C正确;
D.电解饱和食盐水时阳极产生氯气,阴极产生氢气,且体积比为1:1,当电解池两极共有4480mL气体(标准状况)产生时,气体物质的量为0.2mol,则生成氢气物质的量0.1mol,转移的电子为0.2mol,根据电子守恒可知消耗的Li为0.2mol,消耗锂的质量为0.2mol×7g/mol=1.4g,D正确;
故答案为A。

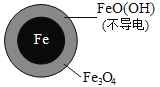
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
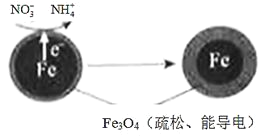
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
【题目】(1)接触法制硫酸工艺中,其主反应是在恒容、温度为450℃并有催化剂存在的条件下进行:
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-190Kj/mol
2SO3(g) ΔH=-190Kj/mol
①下列描述中能说明上述反应已达平衡的是____________。
a. ![]() (O2)正=2
(O2)正=2![]() (SO3)逆 b.容器中气体的密度不随时间而变化
(SO3)逆 b.容器中气体的密度不随时间而变化
c.容器中气体的平均相对分子质量不随时间而变化 d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则![]() (O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
(O2)=__________mol·L-1·min-1,若继续通入0.40 mol SO2和0.20molO2则平
衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol3) <_____mol。
(2)工业生成尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2(g) ![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
①ΔH_______0(填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。
=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___________。

③右图中的B点对应的NH3的平衡转化率为___________。