题目内容
【题目】碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
![]() 铝的基态原子的价电子排布式是_________________。
铝的基态原子的价电子排布式是_________________。
![]() 用水解法制备一种磁性材料铁氧体时常加入尿素
用水解法制备一种磁性材料铁氧体时常加入尿素![]() 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________,分子中![]() 键和
键和![]() 键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
键的数目之比为__________。醋酸钠中碳原子的杂化类型为____________。
![]() 、
、![]() 等金属离子与
等金属离子与![]() 、
、![]() 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,其原因是__________;已知氨
,其原因是__________;已知氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,联氨
,联氨![]() 熔点:
熔点:![]() 、沸点:
、沸点:![]() ,解释其熔沸点高低的主要原因:______________。
,解释其熔沸点高低的主要原因:______________。
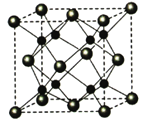
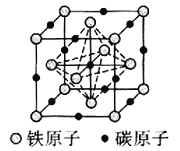
![]() 碳溶解在
碳溶解在![]() 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________。若晶体密度为![]() ,则晶胞中最近的两个碳原子的距离为__________
,则晶胞中最近的两个碳原子的距离为__________![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() 。
。
【答案】![]()
![]()
![]() sp
sp![]() 、sp
、sp![]() 杂化
杂化 ![]() 锌离子的半径较大且含有的空轨道多于镁离子 联氨分子间形成氢键的数目多于氨分子形成的氢键
锌离子的半径较大且含有的空轨道多于镁离子 联氨分子间形成氢键的数目多于氨分子形成的氢键 ![]()
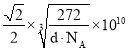
【解析】
![]() 铝为13号元素,它位于元素周期表中第三周期ⅢA族;
铝为13号元素,它位于元素周期表中第三周期ⅢA族;
![]() 同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大;尿素分子的结构式为
同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大;尿素分子的结构式为 ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键;醋酸钠中甲基中碳原子形成4个
键;醋酸钠中甲基中碳原子形成4个![]() 键、另外碳原子形成3个
键、另外碳原子形成3个![]() 键,均没有孤对电子,杂化轨道数目分别为4、3;
键,均没有孤对电子,杂化轨道数目分别为4、3;
![]() 由于锌离子的半径较大且含有的空轨道多于镁离子;氨气分子之间、联氨分子之间都形成氢键;
由于锌离子的半径较大且含有的空轨道多于镁离子;氨气分子之间、联氨分子之间都形成氢键;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心,均摊法计算Fe、C原子数目确定化学式;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离。
![]() 铝为13号元素,它位于元素周期表中第三周期ⅢA族,其价电子排布式为3s
铝为13号元素,它位于元素周期表中第三周期ⅢA族,其价电子排布式为3s![]() 3p
3p![]() ;
;
![]() 同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大,电负性为
同周期主族元素随原子序数增大电负性增大,C、N、O在它们的氢化物中均表现负化合价,说明它们的电负性都比H元素的大,电负性为![]() ;尿素分子的结构式为
;尿素分子的结构式为 ,单键为
,单键为![]() 键,双键含有1个
键,双键含有1个![]() 键、1个
键、1个![]() 键,分子中
键,分子中![]() 键与
键与![]() 键的数目之比为
键的数目之比为![]() ;醋酸钠中甲基中碳原子形成4个
;醋酸钠中甲基中碳原子形成4个![]() 键、另外碳原子形成3个
键、另外碳原子形成3个![]() 键,均没有孤对电子,杂化轨道数目分别为4、3,碳原子的杂化方式分别为sp
键,均没有孤对电子,杂化轨道数目分别为4、3,碳原子的杂化方式分别为sp![]() 、sp
、sp![]() 杂化;
杂化;
![]() 由于锌离子的半径较大且含有的空轨道多于镁离子,因此与NH3、N2H4形成的化合物稳定性相对较高的是Zn2+;氨气分子之间、联氨分子之间都形成氢键,但联氨分子之间形成的氢键更多,联氨的熔沸点高于氨气的;
由于锌离子的半径较大且含有的空轨道多于镁离子,因此与NH3、N2H4形成的化合物稳定性相对较高的是Zn2+;氨气分子之间、联氨分子之间都形成氢键,但联氨分子之间形成的氢键更多,联氨的熔沸点高于氨气的;
(4)Fe原子处于顶点、面心,碳原子处于体心、棱中心,晶胞中Fe原子数目=6×![]() +8×
+8×![]() =4、C原子数目=1+12×
=4、C原子数目=1+12×![]() =4,Fe、C原子数目之比为1:1,故化学式为:FeC;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为r pm,则晶胞棱长=
=4,Fe、C原子数目之比为1:1,故化学式为:FeC;晶胞中最近的两个碳原子的距离为同一顶点的2条棱中心2个碳原子的距离,设晶胞中最近的两个碳原子的距离为r pm,则晶胞棱长=![]() rpm,晶胞质量=dg/cm3×(
rpm,晶胞质量=dg/cm3×(![]() r×10-10cm)3=4×
r×10-10cm)3=4×![]() g,解得r=
g,解得r=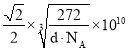 。
。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案