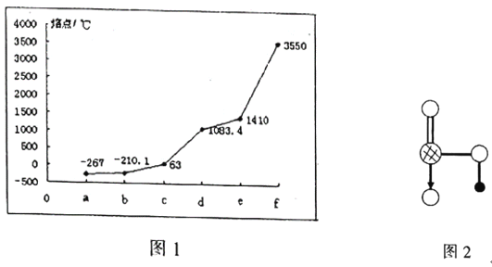
题目内容
【题目】如图所示,若电解5min时铜电极质量增加2.16g,试回答(硝酸银足量):
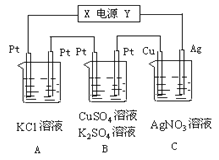
(1)电源电极X名称为____。
(2)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为____。
(3)若A中KCl溶液的体积也是200mL(KCl足量,不考虑氯气的溶解),电解后溶液的c(OH-) =____。
【答案】负极 0.025mol/L 0.1mol/L
【解析】
已知电解5min时铜电极质量增加2.16g,则电解池C中,Cu电极为阴极,Ag为阳极,电解池A、B的左侧电极均为阴极,右侧电极为阳极,电源的X极为负极,Y极为正极,铜电极增重2.16g,电极反应式为Ag++e-=Ag,即物质的量为0.02mol,转移0.02mol电子。
(1)分析可知,电源电极X名称负极;
(2)通电5min时,共转移0.02mol电子,电解硫酸铜溶液,阳极:2H2O-4e-=4H++O2![]() ,转移0.02mol电子时,体积为112mL,阴极:Cu2++2e-=Cu,2H++2e-=H2
,转移0.02mol电子时,体积为112mL,阴极:Cu2++2e-=Cu,2H++2e-=H2![]() ,生成112mL的氢气,得到0.01mol电子,则Cu2+得到0.01mol电子,其物质的量为0.005mol,c(Cu2+)=c(CuSO4)=0.005mol/0.2L=0.025mol/L;
,生成112mL的氢气,得到0.01mol电子,则Cu2+得到0.01mol电子,其物质的量为0.005mol,c(Cu2+)=c(CuSO4)=0.005mol/0.2L=0.025mol/L;
(3)电解KCl溶液,阳极:2Cl-+2e-=Cl2![]() ,阴极:2H2O+2e-=2OH-+H2
,阴极:2H2O+2e-=2OH-+H2![]() ,转移0.02mol电子时,生成0.02molOH-,c(OH-) =0.02mol/0.2L=0.1mol/L。
,转移0.02mol电子时,生成0.02molOH-,c(OH-) =0.02mol/0.2L=0.1mol/L。

练习册系列答案
相关题目