题目内容
5.下列解释中,不正确的是( )| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | MgO的熔点比MgCl2高主要是因为MgO的晶格能比MgCl2大 |
分析 A.分子晶体的稳定性与化学键有关;
B.正负离子半径之比影响离子晶体中离子配位数;
C.极性分子的溶质极易溶于极性分子的溶剂,非极性分子的溶质极易溶于非极性分子的溶剂;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与离子电荷成正比.
解答 解:A.水很稳定,是因为水分子内的共价键较强的缘故,与氢键无关,氢键只影响水的熔沸点,故A错误;
B.正负离子半径之比影响离子晶体中离子配位数,所以由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等,故B正确;
C.碘、四氯化碳、甲烷均是非极性分子,而水是极性溶剂,根据相似相溶原理知,碘易溶于四氯化碳,甲烷难溶于水,故C正确;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与离子电荷成正比,氧离子半径小于氯离子半径,且氧离子所带电荷大于氯离子所带电荷,所以氧化镁晶格能大于氯化镁,则MgO的熔点比MgCl2高,故D正确;
故选A.
点评 本题考查相似相溶原理、晶格能与离子晶体熔沸点关系、化学键与分子稳定性关系等知识点,侧重考查学生分析判断能力,注意氢键和范德华力影响分子晶体熔沸点,但分子的稳定性受化学键影响,注意二者区别,为易错点.

练习册系列答案
相关题目
16.在一定温度下,恒容密闭容器中,充入一定量的NO和O2,发生反应O2(g)+2NO(g)?2NO2(g),反应已达到平衡的标志是( )
| A. | 混合气体的颜色不再变化 | |
| B. | O2、NO、NO2三种物质的反应速率之比为1:2:2 | |
| C. | 反应混合物中各组分物质的浓度相等 | |
| D. | 混合气体的密度不再改变 |
10.下列叙述正确的( )
| A. | 同一周期的非金属元素,由左到右其氧化物对应水化物的酸性依次递增 | |
| B. | aXn-与bYm+两种离子电子层结构相同,则b-a=n+m | |
| C. | 同一主族非金属元素对应氢化物稳定性依次递增,是由于其相对分子质量依次递增、分子间作用力增强所导致的 | |
| D. | 同一主族非金属元素对应氢化物沸点由上到下依次递增 |
17.下列关于离子反应及离子共存的说法中正确的是( )
| A. | 能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 | |
| B. | AlCl3溶液中加入过量的氨水:Al3++4OH-═[Al(OH)4]- | |
| C. | 常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 | |
| D. | NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
14.下列物质中属于有机物的是( )
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
①氰化钠(NaCN) ②丙酮 ③丁炔 ④碳化硅(SiC) ⑤碳酸 ⑥CO ⑦KSCN.
| A. | ①②③④⑦ | B. | ①②③ | C. | ②③ | D. | 全部都是 |
15.下列化合物中不含离子键的是( )
| A. | Na2O | B. | HCl | C. | CaCl2 | D. | Na2CO3 |

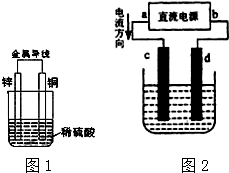 (1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)
(1)请指出锌电极和c电极的电极名称:(正、负、阴、阳)