题目内容
5. 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图象可知,改变条件X,随X的增大,y增大,
A.该反应前后气体体积不变,增大压强平衡不移动;
B.使用催化剂的量,加快反应速率,平衡不移动;
C.充入A,增大A的浓度,平衡向正反应方向移动;
D.降低温度超过活化能Ea的活化分子百分数减小,据此判断.
解答 解:由图象可知,改变条件X,随X的增大,y增大,
A.因为该反应前后气体体积不变,所以增大压强平衡不移动,则C的体积分数不变,故A错误;
B.使用催化剂的量,加快反应速率,平衡不移动,C的平衡浓度不变,故B错误;
C.充入A,增大A的浓度,平衡向正反应方向移动,B的转化率增大,图象与实际相符合,故C正确;
D.降低温度超过活化能Ea的活化分子百分数减小,故D错误;
故选C.
点评 本题考查化学平衡图象、化学平衡影响因素,难度不大,注意理解外界条件对化学平衡的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.
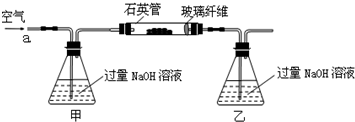
其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O(用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣→②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤→③将滤液稀释至250mL→④取25.00mL稀释液用0.1 000mol/L的酸性KMnO4溶液滴定
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=0.5000mol/L.

其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O(用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣→②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤→③将滤液稀释至250mL→④取25.00mL稀释液用0.1 000mol/L的酸性KMnO4溶液滴定
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
16.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | c(OH-)=$\sqrt{{K}_{W}}$ | |
| C. | 由强酸与强碱等物质的量反应得到的溶液 | |
| D. | 强电解质溶于水得到的溶液 |
13.在标准状况下,与8.8gCO2的体积相等的N2O,下列不相符的是( )
| A. | 质量为8.8g | B. | 物质的量为2mol | ||
| C. | 体积为4.48L | D. | 分子数目为1.204×1023 |
20.下列有关蛋白质和氨基酸的叙述错误的是( )
| A. | 可以用灼烧的方法来区别蚕丝和棉花纤维 | |
| B. | 人体内氨基酸分解代谢的最终产物是二氧化碳、水、尿素 | |
| C. | 人体内所有氨基酸都可以相互转化 | |
| D. | 蛋白质遇硝酸都能显黄色 |
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol.L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 22.4LCl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol-OH与1 molOH-所含电子数均为9 NA |
17.下列性质不属于甲烷性质的是( )
| A. | 完全燃烧时生成CO2和H2O | |
| B. | 常温常压下能溶于水 | |
| C. | 光照下能与卤素单质发生取代反应 | |
| D. | 通常情况下,跟强酸、强碱和强氧化剂不反应 |
14. 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如
图所示.据图判断正确的是( )
 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | b点酸的浓度小于a点酸的浓度 | |
| C. | b点溶液的导电性比c点溶液的导电性弱 | |
| D. | a点Kw的数值比c点Kw的数值小 |
15.已知反应2SO2(g)+O2(g)?2SO3(g),在一定条件下,向2L密闭容器中充入一定物质的量的SO2和O2,2min时,测得n(SO3)=2mol,c(SO2)=0.5mol•L-1 ,下列说法正确的是( )
| A. | 起始时,n(SO2)=2.5mol | B. | 起始时,c(O2)=0.5mol•L-1 | ||
| C. | 0~2min,v(SO3)=0.5mol•L-1•min-1 | D. | 0~2min,O2的转化率为50% |