题目内容
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 1mol.L-1的Ca(ClO)2溶液中含ClO-数目为2NA | |
| B. | 22.4LCl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1 mol-OH与1 molOH-所含电子数均为9 NA |
分析 A、溶液体积不明确;
B、氯气的状态不明确;
C、乙烯和丁烯的最简式均为CH2;
D、羟基不带电荷.
解答 解:A、溶液体积不明确,故溶液中的次氯酸跟的个数无法计算,故A错误;
B、氯气的状态不明确,故氯气的物质的量无法计算,则转移的电子的物质的量无法计算,故B错误;
C、乙烯和丁烯的最简式均为CH2,故21g混合物中含有的CH2的物质的量n=$\frac{m}{M}$=$\frac{21g}{14g/mol}$=1.5mol,则含有的碳原子为1.5NA个,故C正确;
D、羟基不带电荷,故1mol羟基含9mol电子即9NA个;而氢氧根带一个负电荷,故1mol氢氧根含10mol电子即10NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.如图所示的是氢氧燃料电池原理示意图,电解质溶液为中性,按照此图的提示,下列叙述不正确的是( )
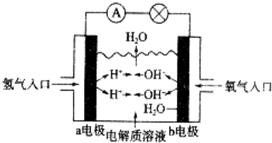

| A. | a电极为负极 | |
| B. | b电极的电极反应式为4OH-→2H2O+O2↑+4e- | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将氧化剂和还原剂全部储藏在电池内的新型发电装置 |
5.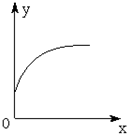 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |
2.下列不属于有机物的是( )
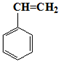
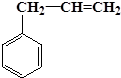
| A. | 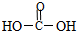 | B. | CCl4 | C. | 蔗糖 | D. | 合成纤维 |
19.下列有关化学反应与能量变化的叙述正确的是( )
| A. | 铝与氧化铁反应既是氧化还原反应,又是吸热反应 | |
| B. | 化学反应中的能量变化只体现为热量的形式 | |
| C. | Ca O+H2O=Ca (OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 | |
| D. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 |
4.Ⅰ制备:目前,我国采用“接触法”制硫酸,设备如图所示:
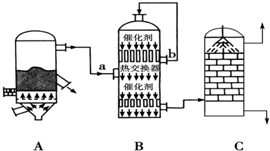
(1)图中设备A的名称是沸腾炉,B设备气流a、b温度较高的是b(填“a”或“b”),C设备中用浓硫酸吸收SO3.
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:4CuFeS2+13O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2Fe2O3+8SO2.
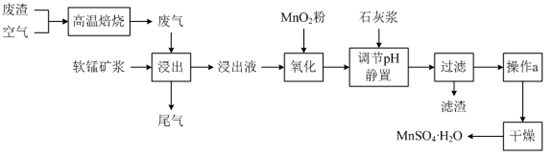
Ⅱ为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7≤pH<8.3.
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是b、c.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液.

(1)图中设备A的名称是沸腾炉,B设备气流a、b温度较高的是b(填“a”或“b”),C设备中用浓硫酸吸收SO3.
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:4CuFeS2+13O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2Fe2O3+8SO2.
Ⅱ为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7≤pH<8.3.
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是b、c.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液.